Файл: Федеральное агенство по образованию рф гоу впо бурятский государственный университет.doc
Добавлен: 27.04.2024
Просмотров: 66
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Примечания:
-
При записи формул, отражающих состав частиц, молекулы воды для простоты опущены. -
Kpq=[Fep(OH)q(OH2)n-q(3p-q)][H+]/[Fe(OH2)n3+]p -
Потенциометрический метод исследования [16]. -
Спектрофотометрический метод исследования [17]. -
Метод ионного обмена [18]. -
Метод ядерной магнитной релаксации [19].
Весьма обычны для Fe(III) анионные комплексы, например оно адсорбируется из солянокислых сред на анионообменной смоле в виде хлоро-комплекса. Спектр поглощения Fe(III) с хлорид - ионом, находит ограниченное применение для определения железа. Гораздо более широкое применение имеет аналогичный комплекс с роданид-ионами. Константы устойчивости роданидных комплексов невелики, поэтому для определения требуется высокая концентрация лиганда (табл.3) [20]. В ряде случаев, невозможно провести определение Fe(II) или Fe(III) при их одновременном присутствии с помощью неорганических реагентов. Эту проблему можно решить при использовании органических аналитических реагентов, т.к. их комплексы с Fe характеризуются большей устойчивостью (табл.3).
Таблица 3
Константы нестойкости некоторых комплексных соединений железа
| Определяемый ион | Вещество | Т,0С | Ионная сила | Кн. |
| Fe2+ | [FeSCN]+ | 25 | 0,6 | 4,70∙10-2 |
| [Fe(CN)6]4- | - | - | 1,00∙10-37 | |
| [FeTart ] | - | - | 4,50∙10-24 | |
| [Fe(Tart)2]2- | - | - | 6,30∙10-39 | |
| [FeEdta]2- | 20 | 0,1 | 3,54∙10-15 | |
| [FeEn]2+ | 30 | 0,1 | 5,25∙10-5 | |
| [FeOx] | 18 | 0,1 | 2,10∙10-5 | |
| [Fe(Ox)2]2- | 25 | 0,5 | 3,00∙10-5 | |
| [FePy]2+ | 25 | 0,5 | 0,195 | |
| Fe3+ | [FeCl]2+ | 25 | - | 3,30∙10-2 |
| [FeF]2+ | 25 | 0,5 | 5,20∙10-6 | |
| [FeHPO4]+ | 30 | 0,7 | 4,44∙10-10 | |
| [FeSCN]2+ | 25 | - | 1,12∙10-3 | |
| [Fe(CN)6]3- | 20 | - | 1,00∙10-44 | |
| [FeSal]+ | - | - | 4,00∙10-17 | |
| [Fe(Sal)2]- | - | - | 1,40∙10-28 | |
| [FeSSal] | 20-30 | 0,2 | 2,29∙10-15 | |
| [FeCit] | 25 | 1,0 | 1,41∙10-12 | |
| [FeEdta]- | 20 | 0,1 | 8,00∙10-26 |
-
Комплексы с органическими лигандами
Железо(III) почти во всех своих комплексах с органическими лигандами находится в энергетически-выгодном состоянии (симметричность и занятость одним электроном d-орбиталей в электронной конфигурации d5). Именно поэтому железо в этой степени окисления образует свои наиболее прочные комплексы с анионными, а не с содержащими азот лигандами. Так, лиганды, применяемые для фотометрического определения Fe(III), могут связывать его с двумя кислородными анионами (пирокатехин, тайрон, салициловая кислота); кислородным и содержащим серу анионами (тиогликолевая и тиосалициловая кислоты); атомами кислорода и кислородным анионом (8-оксихинолин, салицилальдоксим, феррон) [21]. Подобно этому, Fe(III), образует очень прочный комплекс с ЕDTA. Лимонную, щавелевую и винную кислоты можно использовать для маскирования железа или удерживания его в слабокислых или нейтральных растворах. Основные характеристики комплексообразования Fe(III) c этими реагентами представлены в таблице 4[13, 21, 22].
Таблица 4
Комплексные соединения Fe(III)
| Лиганд | Константы комплексообразования | рН | Наблюдаемый эффект | ||
| lgβ11 | lgβ12 | lgβ13 | |||
| Салициловая кислота | 16,4 | 28,3 | 36,8 | 1,8-3,0 | красн./бесцв.(желт.) |
| Тайрон | 20,7 | 35,9 | 46,9 | 2,0-3,0 | синяя/бесцв.(желт.) |
| Тиосалициловая кислота | - | - | - | 2,0 | красн./бесцв.(желт.) |
| Феррон | 8,9 | 17,3 | 25,2 | 2,0-3,0 | зелен./бесв.(желт.) |
| 8-оксихинолин | 12,3 | 23,6 | 33,9 | 2,2-4,0 | темно-зел./бесцв. |
Индикаторы, которые используются для определения Fe(III), типа: роданид, салицилат, сульфосалицилат и тайрон (пирокатехин-3,5-дисульфонат натрия) не являются металлохромными, бесцветны и используются в очень высоких концентрациях. Эти индикаторы обычно менее чувствительны, чем индикаторы-красители, а интенсивность окраски, определяемая человеческим глазом, редко соответствует молярности меньше 10
-5 [13]. Комплексообразование происходит в кислой среде(ацетатный буфер), иногда реакции протекают медленно, как например с EDTA (рН=2,5 t=600С) и требуют подбора оптимальных условий [23].
Известны соединения Fe(III) с диоксинами. Эти комплексы являются малопрочными. Как правило, они образуются в кислой среде. Салицилальдоксим и его производные используют для определения железа(III)(количество железа в слое раствора с поперечным сечением 1см2, дающее экстинкцию 0,001 составляет 0,011г/см2 при λмах=480нм рН=6,2-6,6 [24]). Метод малоселективен, мешают оксикислоты, фосфат-, борат-, цианидионы и многие катионы. Чаще используют 2-окси5-метилпропиофеноксим как в кислой среде(рН=2, λмах=580нм, Fe:H2L=1:1), так и в щелочной (рН=8-9, λмах=480-510нм, Fe:H2L=1:3). При использовании таких соединений для спектрофотометрического определения железа(Ш), свинец и никель могут присутствовать в750-кратных, хром и кобальт-500-кратных, медь-25-кратных количествах [22].
В водных растворах используют комплексообразование железа (III) с оксиэтилидендифосфоновой кислотой (ОЭДФ), т.к. при этом образуются устойчивые комплексы, которые существуют в широком интервале рН [25].
Для определения железа и ряда других металлов (Cu, Ga, Sc, Zr, Co, Ni, Zn, Cd, Pb, V, Th) применяют глицинтимоловый синий [26]. Известно, что ГТС является чувствительным и избирательным (но не специфичным) спектрофотометрическим реагентом на медь. Большинство других катионов взаимодействует слабо, и многие из них не вызывают заметного мешающего влияния, однако это не ограничивает возможность применения этого реагента и для обнаружения этих элементов, в т.ч. и для Fe(III) [20].
Cреди фотометрических методов наиболее чувствительный и широко применяемый, метод с хромазуролом-S. Комплекс железа(III) с данным реактивом характеризуется спектром поглощения с λопт=575 нм и молярным коэффициентом светопоглощения ε=4,3·104, рН=4,0. Недостатками этого метода являются невысокая чувствительность (13 мкг/л) и низкая избирательность. Определению мешают Cu, Co, Ni, Zn, Pb, Ti, Cr, Al, Ga, In и Ge [27].
4-(2-пиридилазо)-резорцин (ПАР) применяется для фотометрического определения железа(III) в природной воде. При рН 8,0 - 9,3 образуется комплексное соединение с λопт=530 нм и ε=6,04·104. Предел обнаружения железа 9,3 мкг/л. Но данный метод отличается низкой избирательностью, определению мешают Cu, Ag, Zn, Cd, Hg, Al, Ga, In, Tl, Sc, J, La, Ce(III), Sn(IV) и для устранения их влияния следует добавлять в исследуемый раствор маскирующие реагенты, что снижает точность и чувствительность анализа. Для повышения селективности метода используют экстракционно-фотометрический вариант, который применен для определения железа в морской воде [27].
Анализ литературных данных по комплексообразованию железа с органическими реагентами показал, что есть сведения о комплексообразовании Fe(III) c ПАР, но нет информации о составе комплекса и его устойчивости. Поэтому представляло интерес исследовать эту фотометрическую реакцию, а также возможность ее применения для фотометрического определения Fe(III) в реальных объектах, в частности – в пищевых продуктах.
Глава II. Комплексообразование в системе: Fe(III) – пиридилазорезорцин
Приборы и реактивы.
-
Исходный раствор Fe(III) с концентрацией 10-2 моль/ дм3 готовили путем растворения навески Fe2(SO4)3(NH4)2SO4*24H2O (m=0,4822 г) в дистиллированной воде (Vк=100 см3). Рабочий раствор получали разбавлением исходного дистиллированной водой. -
Раствор ПАР с концентрацией 10-2 моль/ дм3 готовили путем растворения навески реагента m=0,255 г в дистиллированной воде (Vк=100 см3) (рабочие растворы готовили разбавлением соответствующей аликвоты исходного раствора). -
Растворы солей металлов (Zn2+, Cu2, , Cd2+, Pb2+ , Со2+, Ni2+, Mn2+с концентрацией 1∙10-2 моль/дм3 готовили путем растворения точной навески в дистиллированной воде (Vк.=100см3). -
Боратный буфер[28]. -
Растворы кислот (соляной, азотной), аммиака:
а) с концентрированные: ρ(HCl) = 1,176г/см3, ρ(HNO3) = 1,760г/см3, ρ(NH4OH) = 0,903г/см3
б) с концентрацией 0,1моль/ дм3.
-
Для контроля рН растворов использовали иономер рН Эконикс Эксперт-001 со стеклянным электродом. -
Спектры поглощения снимали на фотоколориметре КФК-3-01, кюветы стеклянные.
2.1. Спектрофотометрическое исследование аналитических характеристик пиридилазорезорцина
П
 АР [4-(2-пиридилазо)резорцин] является двухосновной пятидентатной кислотой.
АР [4-(2-пиридилазо)резорцин] является двухосновной пятидентатной кислотой.В сильнокислой среде он находится в протонированной форме и его растворы окрашены в желтый цвет. С понижением кислотности происходит депротонирование реагента, и в щелочной среде, где диссоциирует фенольный гидроксил, его растворы окрашиваются в оранжевый цвет.
С целью расчета констант диссоциации реагента были сняты его спектры поглощения в широком интервале рН.
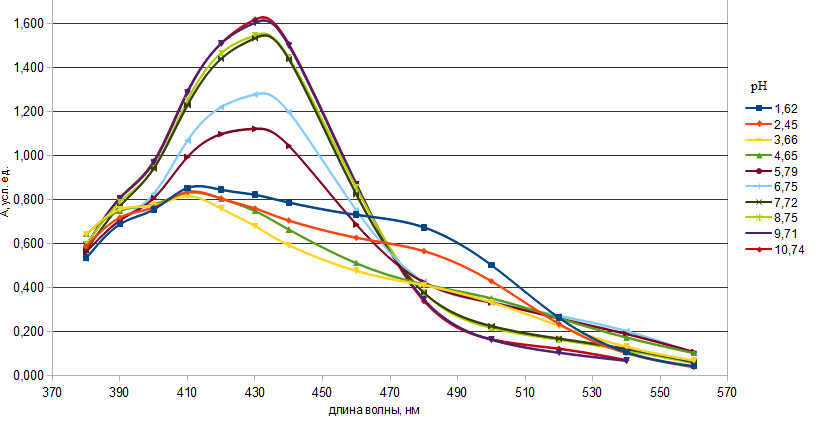
Рис.1. Спектры поглощения ПАР в зависимости от рН
(СПАР = 5*10-5 моль/ дм3, l=10мм)
По спектрам поглощения видно, что полосы поглощения имеют два максимума: четко выраженный при длине волны 430 нм и сглаженный – при 410 нм.

