Файл: 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 69
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
қысым тұрақты жағдайды қолдайды. Бұл процестің атауы қалай?
а) изохоралық
б)изохора- изотермиялық в)изобаралық
д) изобара –изотермиялық е)изотермиялық.
Қысым және температура тұрақты жағдайда химиялық тепе-теңдік шарты қай теңдеуде көрсетілген:
dG=0
Кез-келген процесстің қарқындылық факторы ... аталады? Термодинамикалық потенциал
Дәрілік зат синтезі оқшауланған жүйеде жүреді. Өздігінен
жүретін процесс ағынының критерийі қандай? Энтропия өзгерісі
Фугитивтілік (ұшқыштық) бұл-
Жоғары қысымдағы идеал газдар үшін термодинамикалық қатынасты пайдаланып, реал газдардың қасиеттерін есептеу үшін қолданылатын термодинамикалық функция Фугитивтілік қалай есептеледі?
f=ℽ*P
Изобара-изотермиялық тепе- теңдікте тұрған процессті қалай өрнектеуге болады?
dG=∆H-T∆S
Стандартты емес жағдайдағы химиялық потенциал анықталады:
µ=0
Егер жүйе бастапқы күйден соңғы күйге изотермиялық жолмен ауысса, онда:
∆F=∆H-T∆S
Термодинамикада ашық жүйелер үшін фундаменталды теңдеуді көрсетіңіз:

????=????
dU= TdS – PdV+∑∞
µ????????
Егер жүйе тек қана ұлғаю жұмысын жасаса, келесі дифференциалды теңдеу қолданылады:
dH ≤ TdS + PdV ;
Химиялық тепе-теңдік жағдайы сипатталады
тікелей және кері реакциялар жылдамдығының теңдігімен Динамикалық тепе-теңдік күйіндегі жүйеге катализаторды енгізу
тек тікелей реакция жылдамдығын арттырады
N2 + 3Н2↔2NH3 + Q жүйесіндегі химиялық тепе-теңдікті араластыруға
әсер етпейді катализаторды қолдану
Қандай жағдайларда реакция өздігінен жүре алмайды: ΔS > 0,
Қандай жағдайда реакция өздігінен алға бағытта жүреді? ΔG < 0
Химиялық реакция изохорасының теңдеуі
dln KC
dT
URT2
Химиялық реакция изобарасының теңдеуі
dln KP
dT
HRT2
Идеал жүйелердегі Кр және Кс тепе-теңдік константаларына әсер ететін факторлар:
температура және қысым;
Температураның тепе-теңдік константасына әсерінің өлшемі: энтальпияның өзгеруі;
Температураның көтерілуі тепе-теңдіктің ... реакцияға ауысуын
тудырады.
эндотермиялық;
Температураны төмендету тепе-теңдіктің ... реакцияға ауысуын тудырады.
экзотермиялық;
Егер тепе-теңдік константасы бірден кіші болса, онда олар тепе-теңдік жүйесінде басым болады.
бастапқы заттар;
Химиялық тепе-теңдік күйінде тура реакция жылдамдығы ... кері реакция
тең;
pΔV көбейтіндісімен өлшенетін шаманың өлшем бірлігін
көрсетіңіз
джоуль
Джоульмен өлшенетін физикалық шамаларды таңдаңыз: энтропия
Жылусыйымдылығын өлшеу бірліктерін таңдаңыз: Дж/ г
Энтропия бірліктерін таңдаңыз:
Дж/моль⋅ К
Жылу суық денеден ыстық денеге өте алмайды: термодинамиканың екінші заңы
Қайтымды процесс -
тікелей және кері бағытта жүруі мүмкін процесс Өздігінен жүретін үдеріс -
сыртқы денелердің әсерінсіз үдеріс
Термодинамиканың екінші заңы шағылыстырады...
... ішкі энергияның өздігінен жұмысқа айналу қабілеті Оқшауланған жүйе:
барлық жауаптар дұрыс емес.
Қандай процестің жұмысы оны жүзеге асыру жолына байланысты емес:
тепе-теңдік процесі.
Идеал газдар үшін СР мен СV арасындағы айырмашылық қандай:
8,31 Дж/моль⋅ К
Қандай жүйелер ашық болуы мүмкін:
қоршаған ортамен жылу және материалдық алмасу мүмкін
болатын жүйелер;
Химиялық реакцияға түсетін жүйенің жылу сыйымдылығын өзгерту арқылы анықтауға болады:
химиялық реакцияның жылу эффектінің температуралық коэффициенті;
Заттардың түзілуі мен жануының стандартты жылу негізінде: химиялық реакциялардың жылуы;
Т≠298 к кезіндегі химиялық реакциялардың жылуын есептеу үшін:
Т=298 К кезіндегі химиялық реакцияның тепе-теңдік константасы.
Жүйенің күй функциясы жүйені жүргізу жолынан: тәуелді;
Оқшауланған жүйенің энтропиясы тепе-теңдікке жеткенде қалай өзгереді:
құлап, тепе-теңдік нүктесінде минимумға жетеді;
Оқшауланған жүйеде жүретін процесс бағытының өлшемі ретінде термодинамикалық функциялардың қайсысын қолдануға болады:
S
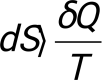 Қайтымсыз процестер үшін 2 термодинамика заңы:
Қайтымсыз процестер үшін 2 термодинамика заңы:
Фазалық ауысулар үшін энтропияның өзгеруі:
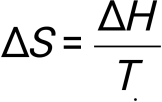
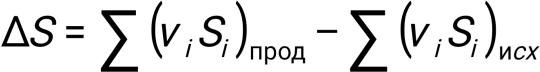 Әр түрлі температурада энтропияның өзгеруін есептеу: Термодинамиканың екінші басталу теңдеуі:
Әр түрлі температурада энтропияның өзгеруін есептеу: Термодинамиканың екінші басталу теңдеуі:
екінші типтегі мәңгілік қозғалтқышты құру мүмкін еместігі туралы постулаттың аналитикалық нысаны;
«Абсолютті нөлдегі жеке кристалды заттың энтропиясы нөлге тең»
термодинамиканың үшінші заңы
Қандай тұжырым Гесс заңына сәйкес келеді:
А) реакцияның жылу эффектісі күй функциясы болып табылады; Б) реакцияның жылу эффектісі процестің өту жолына байланысты; С) реакцияның жылу эффектісі технологиялық жолға байланысты емес
Д) барлық мәлімдемелер шындыққа сәйкес келеді.
Плазма мен эритроциттердегі буферлік жүйе дегеніміз не? Протеин
Аналитикалық (жалпы) концентрация (с) және активтілік (а)
арасындағы тәуелділік:
c=a/γ
Қышқылдар мен негіздердің электронды теориясы (Г. Льюис):
қышқыл-негіз реакцияларында донор-акцептор өзара әрекеттесуі жүреді
ріген заттың молярлық массасын криоскопиялық анықтау үшін келесі қатынастар қолданылады:
 Тқату = Кm2
Тқату = Кm2
Буферлі жүйелер құрамына қарай қалай бөлінеді? қышқылдық, негіздік, амфолиттік
Екіфазалы екі компонентті жүйелерде еркіндік дәрежесі нешеге
тең:
1
Протолиттік теорияға сәйкес негіздер деген:
Қышқыл-негіздік әсерлесу кезінде протондарды қосатын заттар Гетерогенді жүйеде фазалар саны (f):
ф>1
Құрамында 0,01 моль / л Ca (NO3) 2 және 0,01 моль / л CaCl2 бар ерітіндідегі иондық күшті есептеңіз.
0,06
Сұйылтылған FeCl3 ерітінділерінде изотоникалық коэффициент ішіндегі мәндерді қабылдайды:
3 < i < 4
Изотоникалық коэффициент болуы мүмкін: 1-ден көп, бірақ иондар саны аз
Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның
температураға тәуелділігін сипаттайды:
бір компонентті бір фазалы жүйе
Осмостық қысым қай ерітіндіде көбірек болады? С(NaCl) = 0,5 моль/л
Идеал жүйеде еріген заттың тәжірибе жүзінде табылған
молекулалық массасы:
формулалық мәніне тең
Изотондық ерітінділер дегеніміз бірдей ерітінділер: осмостық қысым
Ерітіндінің иондық күші мына формуламен анықталады:
а) изохоралық
б)изохора- изотермиялық в)изобаралық
д) изобара –изотермиялық е)изотермиялық.
Қысым және температура тұрақты жағдайда химиялық тепе-теңдік шарты қай теңдеуде көрсетілген:
dG=0
Кез-келген процесстің қарқындылық факторы ... аталады? Термодинамикалық потенциал
Дәрілік зат синтезі оқшауланған жүйеде жүреді. Өздігінен
жүретін процесс ағынының критерийі қандай? Энтропия өзгерісі
Фугитивтілік (ұшқыштық) бұл-
Жоғары қысымдағы идеал газдар үшін термодинамикалық қатынасты пайдаланып, реал газдардың қасиеттерін есептеу үшін қолданылатын термодинамикалық функция Фугитивтілік қалай есептеледі?
f=ℽ*P
Изобара-изотермиялық тепе- теңдікте тұрған процессті қалай өрнектеуге болады?
dG=∆H-T∆S
Стандартты емес жағдайдағы химиялық потенциал анықталады:
µ=0
Егер жүйе бастапқы күйден соңғы күйге изотермиялық жолмен ауысса, онда:
∆F=∆H-T∆S
Термодинамикада ашық жүйелер үшін фундаменталды теңдеуді көрсетіңіз:

????=????
dU= TdS – PdV+∑∞
µ????????
Егер жүйе тек қана ұлғаю жұмысын жасаса, келесі дифференциалды теңдеу қолданылады:
dH ≤ TdS + PdV ;
Химиялық тепе-теңдік жағдайы сипатталады
тікелей және кері реакциялар жылдамдығының теңдігімен Динамикалық тепе-теңдік күйіндегі жүйеге катализаторды енгізу
тек тікелей реакция жылдамдығын арттырады
N2 + 3Н2↔2NH3 + Q жүйесіндегі химиялық тепе-теңдікті араластыруға
әсер етпейді катализаторды қолдану
Қандай жағдайларда реакция өздігінен жүре алмайды: ΔS > 0,
Қандай жағдайда реакция өздігінен алға бағытта жүреді? ΔG < 0
Химиялық реакция изохорасының теңдеуі
dln KC
dT
URT2
Химиялық реакция изобарасының теңдеуі
dln KP
dT
HRT2
Идеал жүйелердегі Кр және Кс тепе-теңдік константаларына әсер ететін факторлар:
температура және қысым;
Температураның тепе-теңдік константасына әсерінің өлшемі: энтальпияның өзгеруі;
Температураның көтерілуі тепе-теңдіктің ... реакцияға ауысуын
тудырады.
эндотермиялық;
Температураны төмендету тепе-теңдіктің ... реакцияға ауысуын тудырады.
экзотермиялық;
Егер тепе-теңдік константасы бірден кіші болса, онда олар тепе-теңдік жүйесінде басым болады.
бастапқы заттар;
Химиялық тепе-теңдік күйінде тура реакция жылдамдығы ... кері реакция
тең;
pΔV көбейтіндісімен өлшенетін шаманың өлшем бірлігін
көрсетіңіз
джоуль
Джоульмен өлшенетін физикалық шамаларды таңдаңыз: энтропия
Жылусыйымдылығын өлшеу бірліктерін таңдаңыз: Дж/ г
Энтропия бірліктерін таңдаңыз:
Дж/моль⋅ К
Жылу суық денеден ыстық денеге өте алмайды: термодинамиканың екінші заңы
Қайтымды процесс -
тікелей және кері бағытта жүруі мүмкін процесс Өздігінен жүретін үдеріс -
сыртқы денелердің әсерінсіз үдеріс
Термодинамиканың екінші заңы шағылыстырады...
... ішкі энергияның өздігінен жұмысқа айналу қабілеті Оқшауланған жүйе:
барлық жауаптар дұрыс емес.
Қандай процестің жұмысы оны жүзеге асыру жолына байланысты емес:
тепе-теңдік процесі.
Идеал газдар үшін СР мен СV арасындағы айырмашылық қандай:
8,31 Дж/моль⋅ К
Қандай жүйелер ашық болуы мүмкін:
қоршаған ортамен жылу және материалдық алмасу мүмкін
болатын жүйелер;
Химиялық реакцияға түсетін жүйенің жылу сыйымдылығын өзгерту арқылы анықтауға болады:
химиялық реакцияның жылу эффектінің температуралық коэффициенті;
Заттардың түзілуі мен жануының стандартты жылу негізінде: химиялық реакциялардың жылуы;
Т≠298 к кезіндегі химиялық реакциялардың жылуын есептеу үшін:
Т=298 К кезіндегі химиялық реакцияның тепе-теңдік константасы.
Жүйенің күй функциясы жүйені жүргізу жолынан: тәуелді;
Оқшауланған жүйенің энтропиясы тепе-теңдікке жеткенде қалай өзгереді:
құлап, тепе-теңдік нүктесінде минимумға жетеді;
Оқшауланған жүйеде жүретін процесс бағытының өлшемі ретінде термодинамикалық функциялардың қайсысын қолдануға болады:
S
Фазалық ауысулар үшін энтропияның өзгеруі:
екінші типтегі мәңгілік қозғалтқышты құру мүмкін еместігі туралы постулаттың аналитикалық нысаны;
«Абсолютті нөлдегі жеке кристалды заттың энтропиясы нөлге тең»
термодинамиканың үшінші заңы
Қандай тұжырым Гесс заңына сәйкес келеді:
А) реакцияның жылу эффектісі күй функциясы болып табылады; Б) реакцияның жылу эффектісі процестің өту жолына байланысты; С) реакцияның жылу эффектісі технологиялық жолға байланысты емес
Д) барлық мәлімдемелер шындыққа сәйкес келеді.
- 1 ... 5 6 7 8 9 10 11 12 ... 28
апта
Плазма мен эритроциттердегі буферлік жүйе дегеніміз не? Протеин
Аналитикалық (жалпы) концентрация (с) және активтілік (а)
арасындағы тәуелділік:
c=a/γ
Қышқылдар мен негіздердің электронды теориясы (Г. Льюис):
қышқыл-негіз реакцияларында донор-акцептор өзара әрекеттесуі жүреді
ріген заттың молярлық массасын криоскопиялық анықтау үшін келесі қатынастар қолданылады:
Буферлі жүйелер құрамына қарай қалай бөлінеді? қышқылдық, негіздік, амфолиттік
Екіфазалы екі компонентті жүйелерде еркіндік дәрежесі нешеге
тең:
1
Протолиттік теорияға сәйкес негіздер деген:
Қышқыл-негіздік әсерлесу кезінде протондарды қосатын заттар Гетерогенді жүйеде фазалар саны (f):
ф>1
Құрамында 0,01 моль / л Ca (NO3) 2 және 0,01 моль / л CaCl2 бар ерітіндідегі иондық күшті есептеңіз.
0,06
Сұйылтылған FeCl3 ерітінділерінде изотоникалық коэффициент ішіндегі мәндерді қабылдайды:
3 < i < 4
Изотоникалық коэффициент болуы мүмкін: 1-ден көп, бірақ иондар саны аз
Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның
температураға тәуелділігін сипаттайды:
бір компонентті бір фазалы жүйе
Осмостық қысым қай ерітіндіде көбірек болады? С(NaCl) = 0,5 моль/л
Идеал жүйеде еріген заттың тәжірибе жүзінде табылған
молекулалық массасы:
формулалық мәніне тең
Изотондық ерітінділер дегеніміз бірдей ерітінділер: осмостық қысым
Ерітіндінің иондық күші мына формуламен анықталады:
