Файл: Методические указания для выполнения лабораторных работ для студентов бакалавриата направлений 21. 03. 01 Нефтегазовое дело.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 287
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2 Определение теплоты диссоциации слабой кислоты
Электропроводность растворов электролитов
Термодинамика электрохимических систем
Строение вещества. Молекулярные спектры
Поверхностные явления. Сорбция
Лабораторная работа № 8. Исследование кинетики молекулярной адсорбции
Лабораторная работа № 9. Исследование обменной адсорбции ионов
Лабораторная работа № 10. Исследование кинетики ионообменной адсорбции
Устойчивость дисперсных систем
Лабораторная работа № 11. Изучение коагуляции гидрозоля железа
строят графическую зависимость в координатах, указанных на рис. 9. Экстраполяцией линейной зависимости на нуль получают на оси ординат отрезок 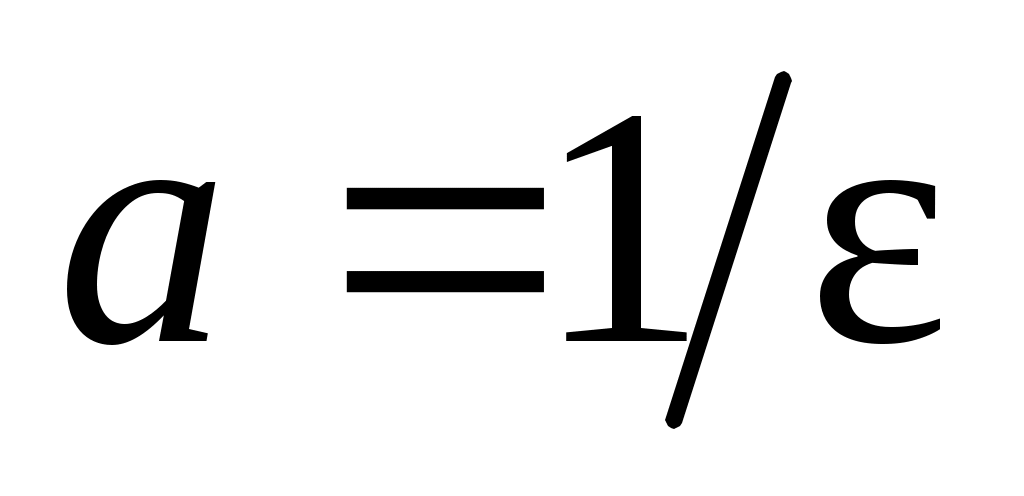 , а тангенс угла наклона позволяет вычислить константу нестойкости:
, а тангенс угла наклона позволяет вычислить константу нестойкости: 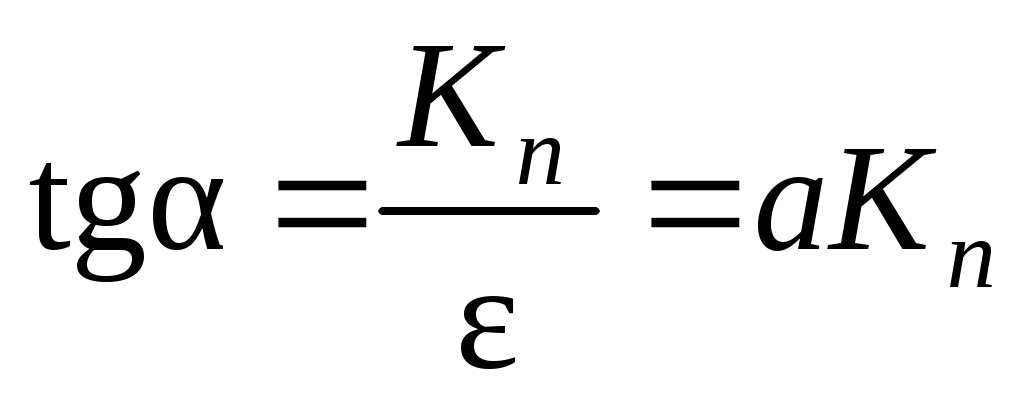 . Таким образом:
. Таким образом:
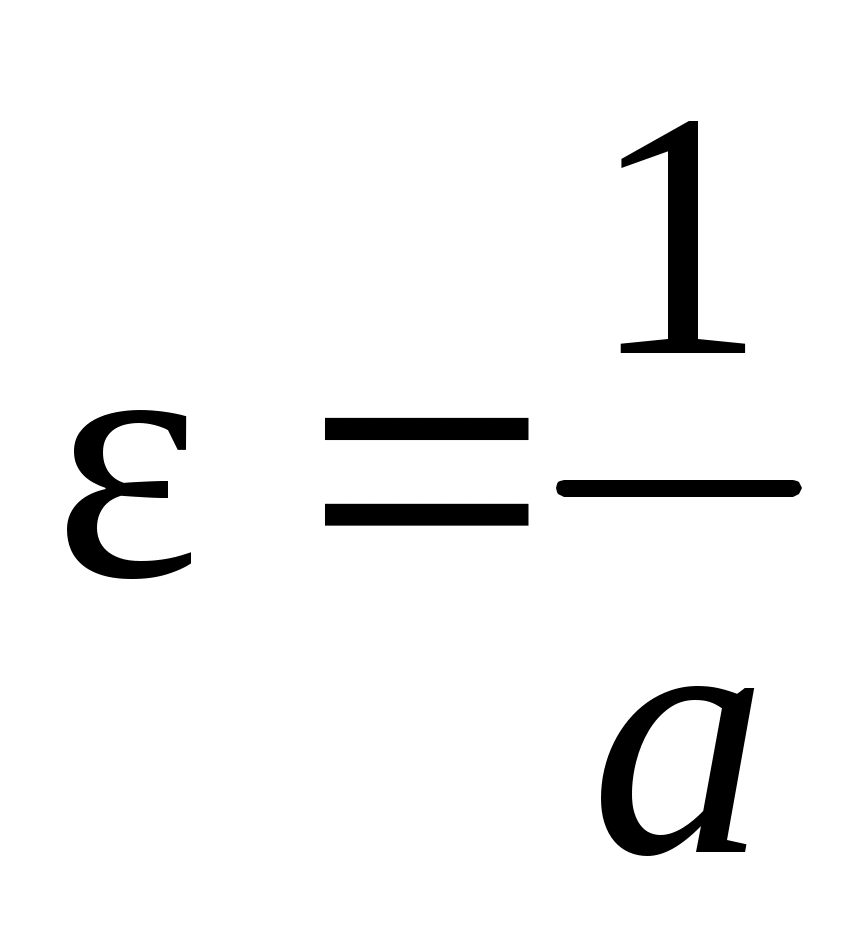 и
и 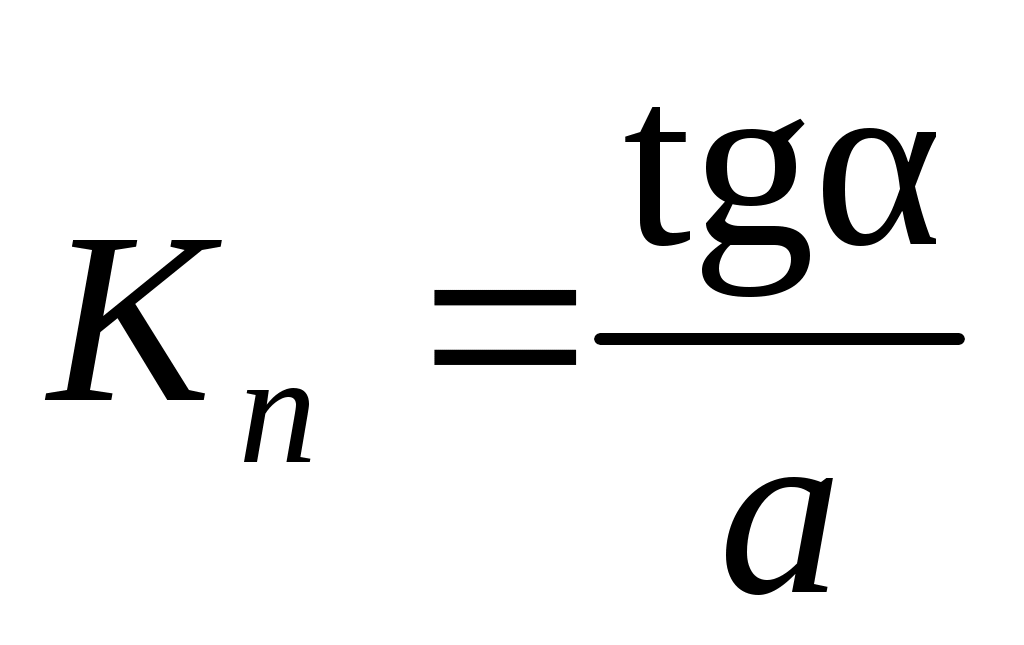 .
.
Следует отметить, что данная зависимость будет линейной только в той области концентраций тиоцианат-иона, в которой в растворе преобладает комплекс с определенным координационным числом n. В общем случае на графике по оси абсцисс следует откладывать значения [KSCN]−n, где n = 1, 2, 3, 4. Кривые будут иметь линейные участки в области преобладания в растворе комплексов с данным n, которым можно определить и Kn этих комплексов.
По значениям констант нестойкости определяют энергии Гиббса образования тиоцианатных комплексов железа (III) по n ступеням:
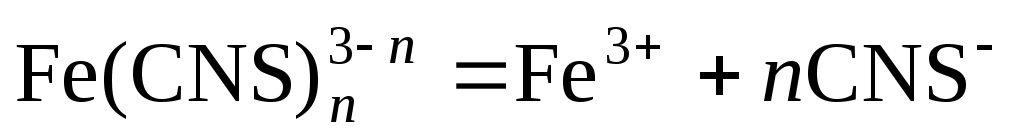 ,
,
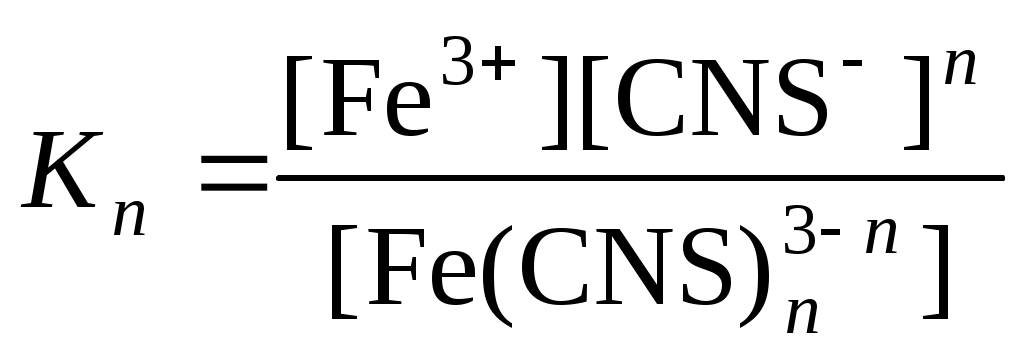 .
.
Свободная энергия диссоциации комплекса на ионы равна:
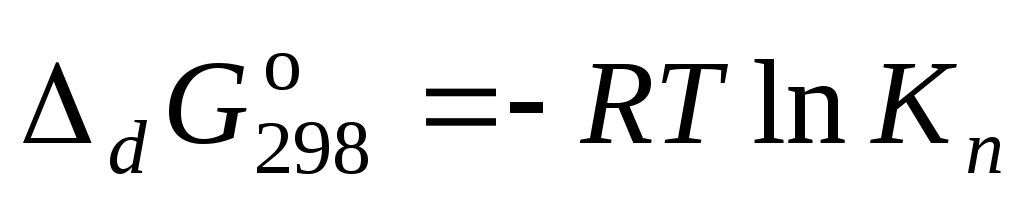 .
.
С другой стороны, по закону Гесса:
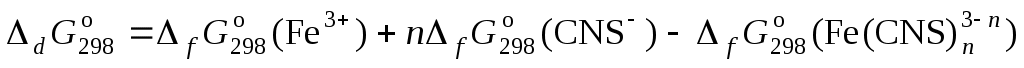
отсюда свободная энергия образования комплексов равна:
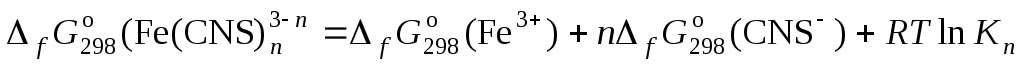
Значения энергий Гиббса образования ионов железа (3+) и тиоцианат-иона берут из справочника.
Таким образом, фотометрический метод позволяет определить константы нестойкости и энергии образования комплексных ионов в растворах, которые используют для расчета ионных равновесий, например, растворимости солей и минералов в присутствии комплексообразующих лигандов.
1. Какому состоянию атома (молекулы) соответствует наиболее низкий уровень энергии?
2. При каких условиях возникает спектр поглощения?
3. Каким уравнением описывается величина кванта света, поглощаемого молекулой?
4. Как связаны между собой частота, длина волны и волновое число?
5. К изменению каких энергетических параметров молекулы приводит поглощение ею квантов света?
6. Какова формула уравнения Бугера-Ламберта-Беера?
7. От каких параметров зависит величина оптической плотности?
8. Что такое молярный коэффициент поглощения?
9. Что такое спектр поглощения?
10. Что такое константа нестойкости?
11. От каких параметров зависит величина константы нестойкости?
12. В каких координатах строят зависимость для графического определения константы нестойкости?
13. Какую экспериментальную зависимость необходимо получить для экспериментального определения величины константы нестойкости тиоцианата железа (III)?
Цель работы
Определение константы нестойкости и энергии Гиббса образования тиоцианатного комплекса железа (III).
Сущность работы
С помощью фотометрического исследования окрашенных комплексов в растворах можно определить их состав и константу нестойкости.
Оборудование и реактивы
Фотоколориметр; мерная колба объемом 100 мл – 1 шт.; мерные колбы объемом 50 мл – 8 шт.; пипетки градуированные объемом 10 мл – 2 шт.; пипетка мерная объемом 5 мл – 1 шт.; пипетка мерная объемом 1 мл – 1 шт.; маркированные химические стаканы объемом 100 мл – 3 шт.; химический толстостенный стакан объемом 75 мл – 1 шт.; груша или шприц – 1 шт.; стандартный раствор соли железа (концентрация реактива указана на емкости с раствором); азотная кислота – раствор, разбавленный 1:1; роданид аммония (или роданид калия) – 1 М раствор.
Выполнение работы
1. Приготовить рабочий раствор соли железа.
1.1) в маркированный химический стакан отобрать порцию стандартного раствора соли железа объемом около 10 мл.
1.2) из химического стакана в мерную колбу объемом 200 (250) мл мерной пипеткой вместимостью 5 мл отобрать 5 мл стандартного раствора соли железа.
!!!Обратить внимание на маркировку мерной колбы!!!
1.3) довести уровень жидкости в мерной колбе дистиллированной водой до метки.
1.4) закрыть колбу пробкой и перемешать раствор, переворачивая мерную колбу не менее 40 раз.
После приготовления рабочего раствора стандартный раствор соли железа убирают.
2. В мерные колбы вместимостью 50 мл с № 1 по № 7
2.1) мерной пипеткой вместимостью 5 мл отбирают по 5 мл рабочего раствора железа,
2.2) при помощи шприца приливают по 1 мл азотной кислоты,
2.3) при помощи градуированной пипетки объемом 10 мл отбирают раствор роданида калия от 2 до 8 мл с шагом в 1 мл (см. табл. «Зависимость оптической плотности от количества роданида калия»).
3. В мерную колбу вместимостью 50 мл для приготовления раствора сравнения (№ 8)
3.1) при помощи шприца приливают 1 мл азотной кислоты,
3.2) при помощи градуированной пипетки объемом 10 мл помещают 4 мл 1 М раствора роданида калия (или аммония).
4. Объем жидкости во всех колбах вместимостью 50 мл довести до метки дистиллированной водой.
5. Колбы закрыть пробками и хорошо перемешать.
6. При приготовлении раствора сравнения необходимо иметь в виду, что это раствор не должен быть окрашен. Присутствие окраски указывает на неверное приготовление раствора.
7. Измерить оптические плотности растворов в кюветах толщиной 1 см при длине волны 480 нм относительно раствора сравнения.
8. Результаты эксперимента занести в таблицу «Зависимость оптической плотности от количества роданида калия».
Содержание протокола лабораторной работы
Зависимость оптической плотности от количества роданида калия
Обработка результатов эксперимента
1. Заполнить таблицу:
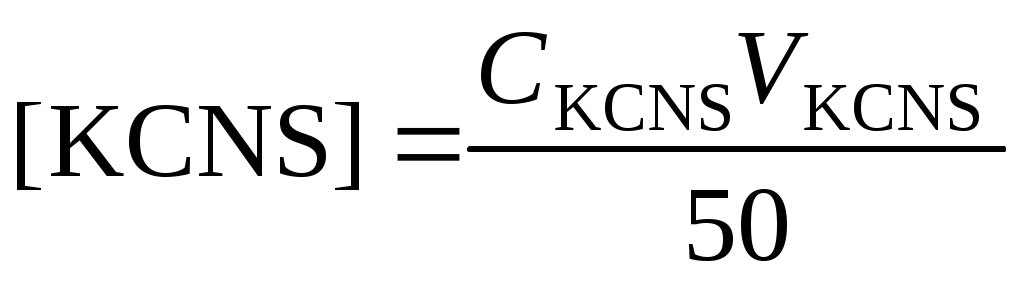 ,
,
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл;
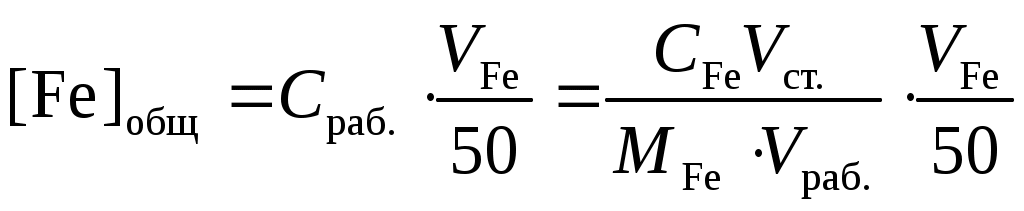 , моль/л.
, моль/л.
2. По данным таблицы построить 3 графика в координатах
а) [Fe]общ/D = f([KCNS]-1),
б) [Fe]общ/D = f([KCNS]-2),
в) [Fe]общ/D = f([KCNS]-3).
3. Для каждого графика построить линию тренда (формат линии тренда: аппроксимация – линейная, показывать уравнение на диаграмме, поместить на диаграмму величину достоверности аппроксимации R2).
4. По уравнениям линий тренда для каждого из трех случаев вычислить значения констант нестойкости по формуле:
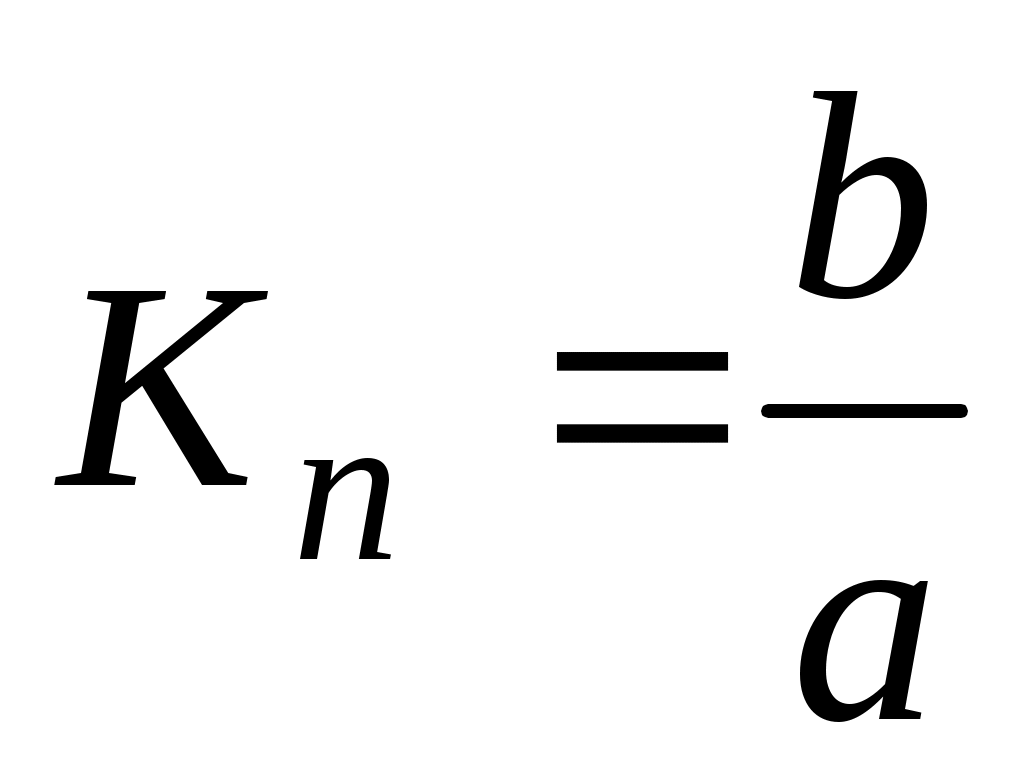 ,
,
где a – линейный член уравнения линии тренда, b – угловой коэффициент уравнения линии тренда.
5. Вычислить изменение энергии Гиббса диссоциации роданидного комплекса железа по формуле:
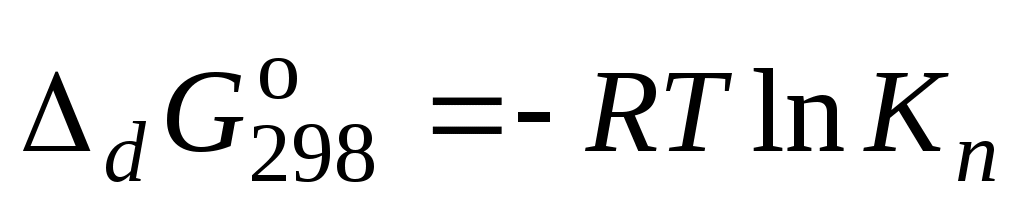
6. Определить значение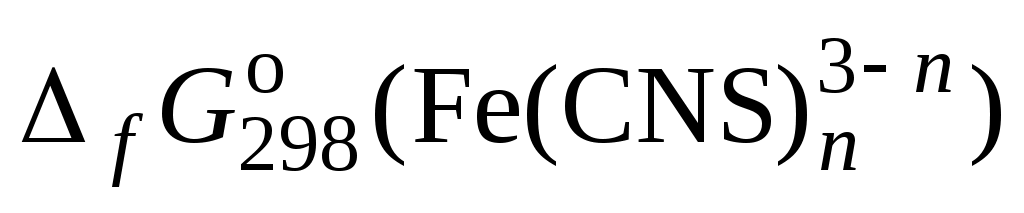 по формуле:
по формуле:
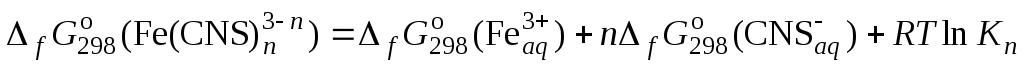 ,
,
где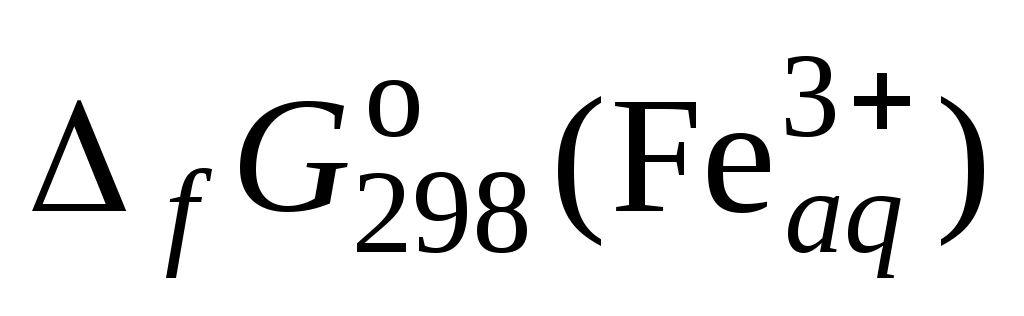
Следует отметить, что данная зависимость будет линейной только в той области концентраций тиоцианат-иона, в которой в растворе преобладает комплекс с определенным координационным числом n. В общем случае на графике по оси абсцисс следует откладывать значения [KSCN]−n, где n = 1, 2, 3, 4. Кривые будут иметь линейные участки в области преобладания в растворе комплексов с данным n, которым можно определить и Kn этих комплексов.
По значениям констант нестойкости определяют энергии Гиббса образования тиоцианатных комплексов железа (III) по n ступеням:
Свободная энергия диссоциации комплекса на ионы равна:
С другой стороны, по закону Гесса:
отсюда свободная энергия образования комплексов равна:
Значения энергий Гиббса образования ионов железа (3+) и тиоцианат-иона берут из справочника.
Таким образом, фотометрический метод позволяет определить константы нестойкости и энергии образования комплексных ионов в растворах, которые используют для расчета ионных равновесий, например, растворимости солей и минералов в присутствии комплексообразующих лигандов.
Контрольные вопросы
1. Какому состоянию атома (молекулы) соответствует наиболее низкий уровень энергии?
2. При каких условиях возникает спектр поглощения?
3. Каким уравнением описывается величина кванта света, поглощаемого молекулой?
4. Как связаны между собой частота, длина волны и волновое число?
5. К изменению каких энергетических параметров молекулы приводит поглощение ею квантов света?
6. Какова формула уравнения Бугера-Ламберта-Беера?
7. От каких параметров зависит величина оптической плотности?
8. Что такое молярный коэффициент поглощения?
9. Что такое спектр поглощения?
10. Что такое константа нестойкости?
11. От каких параметров зависит величина константы нестойкости?
12. В каких координатах строят зависимость для графического определения константы нестойкости?
13. Какую экспериментальную зависимость необходимо получить для экспериментального определения величины константы нестойкости тиоцианата железа (III)?
Лабораторная работа № 5. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
Цель работы
Определение константы нестойкости и энергии Гиббса образования тиоцианатного комплекса железа (III).
Сущность работы
С помощью фотометрического исследования окрашенных комплексов в растворах можно определить их состав и константу нестойкости.
Оборудование и реактивы
Фотоколориметр; мерная колба объемом 100 мл – 1 шт.; мерные колбы объемом 50 мл – 8 шт.; пипетки градуированные объемом 10 мл – 2 шт.; пипетка мерная объемом 5 мл – 1 шт.; пипетка мерная объемом 1 мл – 1 шт.; маркированные химические стаканы объемом 100 мл – 3 шт.; химический толстостенный стакан объемом 75 мл – 1 шт.; груша или шприц – 1 шт.; стандартный раствор соли железа (концентрация реактива указана на емкости с раствором); азотная кислота – раствор, разбавленный 1:1; роданид аммония (или роданид калия) – 1 М раствор.
Выполнение работы
1. Приготовить рабочий раствор соли железа.
1.1) в маркированный химический стакан отобрать порцию стандартного раствора соли железа объемом около 10 мл.
1.2) из химического стакана в мерную колбу объемом 200 (250) мл мерной пипеткой вместимостью 5 мл отобрать 5 мл стандартного раствора соли железа.
!!!Обратить внимание на маркировку мерной колбы!!!
1.3) довести уровень жидкости в мерной колбе дистиллированной водой до метки.
1.4) закрыть колбу пробкой и перемешать раствор, переворачивая мерную колбу не менее 40 раз.
После приготовления рабочего раствора стандартный раствор соли железа убирают.
2. В мерные колбы вместимостью 50 мл с № 1 по № 7
2.1) мерной пипеткой вместимостью 5 мл отбирают по 5 мл рабочего раствора железа,
2.2) при помощи шприца приливают по 1 мл азотной кислоты,
2.3) при помощи градуированной пипетки объемом 10 мл отбирают раствор роданида калия от 2 до 8 мл с шагом в 1 мл (см. табл. «Зависимость оптической плотности от количества роданида калия»).
3. В мерную колбу вместимостью 50 мл для приготовления раствора сравнения (№ 8)
3.1) при помощи шприца приливают 1 мл азотной кислоты,
3.2) при помощи градуированной пипетки объемом 10 мл помещают 4 мл 1 М раствора роданида калия (или аммония).
4. Объем жидкости во всех колбах вместимостью 50 мл довести до метки дистиллированной водой.
5. Колбы закрыть пробками и хорошо перемешать.
6. При приготовлении раствора сравнения необходимо иметь в виду, что это раствор не должен быть окрашен. Присутствие окраски указывает на неверное приготовление раствора.
7. Измерить оптические плотности растворов в кюветах толщиной 1 см при длине волны 480 нм относительно раствора сравнения.
8. Результаты эксперимента занести в таблицу «Зависимость оптической плотности от количества роданида калия».
Содержание протокола лабораторной работы
| Концентрация стандартного раствора соли железа СFe, г/л | |
| Объем стандартного раствора, взятый для приготовления рабочего раствора Vст, мл | |
| Объем приготовленного рабочего раствора соли железа Vраб., мл | |
| Объем рабочего раствора, взятый для выполнения опыта в колбы на 50 млVFe, мл | |
| Концентрация раствора роданида калия (аммония) СKCNS, моль/л | |
| Толщина кюветы l, см | |
| Длина волны, λ, нм | |
Зависимость оптической плотности от количества роданида калия
| № | VFe, мл | V(HNO3), мл | VKSCN, мл | D |
| 1 | 5 | 1 | 2 | |
| 2 | 5 | 1 | 3 | |
| 3 | 5 | 1 | 4 | |
| 4 | 5 | 1 | 5 | |
| 5 | 5 | 1 | 6 | |
| 6 | 5 | 1 | 7 | |
| 7 | 5 | 1 | 8 | |
| 8 | 0 | 1 | 4 | раствор сравнения |
Обработка результатов эксперимента
1. Заполнить таблицу:
| [Fe]общ, моль/л | VKSCN, мл | D | | [KSCN], моль/л | [KSCN]−1 | [KSCN]−2 | [KSCN]−3 |
| | | | | | | | |
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл;
2. По данным таблицы построить 3 графика в координатах
а) [Fe]общ/D = f([KCNS]-1),
б) [Fe]общ/D = f([KCNS]-2),
в) [Fe]общ/D = f([KCNS]-3).
3. Для каждого графика построить линию тренда (формат линии тренда: аппроксимация – линейная, показывать уравнение на диаграмме, поместить на диаграмму величину достоверности аппроксимации R2).
4. По уравнениям линий тренда для каждого из трех случаев вычислить значения констант нестойкости по формуле:
где a – линейный член уравнения линии тренда, b – угловой коэффициент уравнения линии тренда.
5. Вычислить изменение энергии Гиббса диссоциации роданидного комплекса железа по формуле:
6. Определить значение
где

