ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 104
Скачиваний: 0
СОДЕРЖАНИЕ
Последовательность выполнения операций:
2.2. Примеры расчёта параметров равновесных гомогенных систем
2.3. Примеры расчёта параметров равновесных гетерогенных систем
2.4. Задания контрольной работы № 1.
3.1. Примеры расчётов в гравиметрическом методе
3.2. Примеры расчётов в титриметрическом методе
В 100 г раствора содержится 30 г
З А Д А Н И Е № 7
1.Объясните механизм действия аммонийного и ацетатного буферного растворов при взаимодействии их компонентов с соляной кислотой и гидроксидом натрия.
2.Какова буферная ёмкость раствора, содержащего (X) моль соли и (Y) моль кислоты (или основания) в 1 дм3, составляющих буферную смесь (Z) (табл.8)?
Таблица 8
Варианты задания 7
|
Количество моль соли (Х) |
Количество моль кислоты (или основания) (Y) |
Буферная смесь (Z) |
|
0 0,0100 1 0,0200 2 0,0250 3 0,0500 4 0,1000 5 0,2000 6 0,2500 7 0,3000 8 0,5000 9 1,0000
|
0 0,0100 1 0,0200 2 0,0250 3 0,0500 4 0,1000 5 0,2000 6 0,2500 7 0,3000 8 0,5000 9 1,0000
|
0 Ацетная 1 Аммонийная 2 Формиатная 3 Аммонийная 4 Бензоатная 5 Аммонийная 6 Ацетатная 7 Аммонийная 8 Формиатная 9 Аммонийная
|
3.Как изменится рН аммонийного буферного раствора с концентрацией компонентов 1 моль/дм3 при добавлении к 1 дм3 его (Y) моль вещества (Z) (табл.9)?
Таблица 9.
Варианты задания 7
|
Количество моль вещества (Y) |
Вещество (Z) |
|
0 0,1000 1 0,0800 2 0,0600 3 0,0500 4 0,0250 5 0,0200 6 0,0150 7 0,0100 8 0,0050 9 0,0010
|
0 KOH 1 HCl 2 NaOH 3 HNO3 4 KOH 5 H2SO4 6 NaOH 7 HI 8 H2SO4 9 KOH
|
З А Д А Н И Е № 8
1.Поясните на примерах влияние одноимённого иона, "солевого эффекта" и действия кислот на растворимость малорастворимых осадков.
2.Сформулируйте правило произведения растворимости. Приведите примеры дробного осаждения и поясните на чём оно основано.
3.Выпадет ли осадок, если к 1 дм3 раствора AgNO3 с концентрацией 0,001 моль/дм3 прибавить 500 см3 раствора реагента (Y) с молярной концентрацией (Z) (табл.10)?
Таблица 10
Варианты задания 8
|
Реагент (Y) |
Молярная концентрация (Z), моль/дм3 |
|
0 Na3AsO3 1 KBr 2 MgI2 3 HCl 4 KCN 5 Na3PO4 6 Mg2SO4 7 K2Cr2O7 8 (NH4)2CrO4 9 SrCO3
|
0 0,0100 1 0,0200 2 0,0250 3 0,0300 4 0,0400 5 0,0050 6 0,0060 7 0,0025 8 0,0150 9 0,0010
|
3. Контрольная работа № 2
Приступая к выполнению заданий контрольной работы №2,студент должен проработать по рекомендуемой литературе следующие вопросы:
-сущность гравиметрического анализа, классификация методов в гравиметрии;
-требования, предъявляемые к реакциям, осадкам, выбору осадителя и его количеству;
-влияние различных факторов на растворимость осадков, явления соосаждения и окклюзии;
-образование кристаллических и аморфных осадков, их свойства;
-техника общих операций гравиметрического метода (растворение, осаждение, фильтрование, промывание, высушивание и прокаливание осадков);
-область применения и возможности титриметрических методов анализа, их классификации;
-стандартные вещества и предъявляемые к ним требования;
-рабочие и стандартные растворы, способы их приготовления и стандартизации, условия хранения;
-фактор эквивалентности и расчёт молярной массы эквивалента вещества;
-способы фиксирования точки стехиометричности;
-индикаторы, общая характеристика (интервал перехода, показатель титрования), предъявляемые к ним требования, механизм изменения окраски индикаторов;
-построение и анализ кривых титрования, выбор индикатора;
-расчёт результатов анализа.
3.1. Примеры расчётов в гравиметрическом методе
Для определения того или иного элемента (или соединения) в ходе гравиметрического анализа по методу осаждения взвешивают эквивалентное количество другого соединения - гравиметрическую (весовую) форму. Так, при определении бария в сульфате бария взвешивают не элементарный барий, а полученную при анализе гравиметрическую форму - BaSO4 ,а массу бария рассчитывают по формуле:
![]() ,
г (11)
,
г (11)
Вычисляют фактор пересчёта (гравиметрический фактор), т.е. отношение молярной массы определяемого компонента к молярной массе гравиметрической формы :
![]() (12)
(12)
Вместо формулы (11) можно записать :
m(Ba) = m(BaSO4) . F , г (13)
При анализе, имеющем практическое значение, в большинстве случаев рассчитывают массовую долю (%) определяемого компонента в анализируемом веществе :
![]() (14)
(14)
Р Е Ш Е Н И Е Т И П О В Ы Х З А Д А Ч
З а д а ч а 1. Вычислить навеску Ca3(PO4)2 ,если степень чистоты его 98 % и масса гравиметрической формы - CaO равна 0,6455 г.
Р е ш е н и е. 1) Рассчитывают гравиметрический фактор :
![]()
2) Находят массу чистого фосфата кальция, соответствующую 0,6455 г CaO:
m(Ca3(PO4)2) = m(CaO) . F = 0,6455 . 1,843 = 1,1897г.
Следует отметить, что точность гравиметрических методов определяется погрешностью взвешивания на аналитических весах (в зависимости от конструкции - (1 - 2).10-4 г), поэтому массу вещества (в граммах) записывают до четырёх цифр после запятой.
3) Рассчитывают навеску фосфата кальция по известной степени чистоты анализируемого вещества :
q(Ca3(PO4)2)
=
![]() = 1,2140 г.
= 1,2140 г.
О т в е т: навеска фосфата кальция равна 1,2140 г.
З а д а ч а 2. Рассчитать массовую долю алюминия в образце Al(NO3)3.9H2O, если навеска анализируемого образца равна 1,7000 г, а масса гравиметрической формы Al2O3 - 0,2865 г.
Р е ш е н и е. 1) Находят гравиметрический фактор :
![]()
2) Рассчитаем массовую долю алюминия по формуле (14) :
W
=
![]() = 8,92 %
= 8,92 %
О т в е т: массовая доля алюминия в образце составляет 8,92 %.
3.2. Примеры расчётов в титриметрическом методе
Расчёты результатов титриметрического анализа основаны на законе эквивалентов, согласно которому вещества реагируют между собой в эквивалентных количествах, которые рассчитываются по формуле :
![]() (15)
(15)
При решении задач рекомендуется придерживаться следующего плана:
1) выяснить метод анализа и составить соответствующую реакцию;
2) обратить внимание на достаточность данных в условии задачи (недостающие величины следует найти в справочной литературе);
3) обозначить количество каждого реагирующего вещества числом эквивалентов и составить расчётную формулу;
4) обратите внимание на размерность величин, они должны быть приведены к одной системе единиц;
5) ввести числовые значения в расчётную формулу и произвести вычисления.
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
З а д а ч а 1. Рассчитать навеску тетрабората натрия, необходимую для приготовления 500 см3 раствора с молярной концентрацией эквивалента 0,1500 моль/дм3
Р е ш е н и е. 1) Вычисляют фактор эквивалентности и молярную массу эквивалента Na2B4O7.10H2O
Тетраборат натрия применяется в качестве стандартного вещества в методе кислотно-основного титрования : f(Na2B4O7).10H2O = 1/2.
М(1/2 Na2B4O7.10H2O) = 1/2M(Na2B4O7.10H2O) = 1/2.381,4 = 190,7 г/моль
2) Рассчитывают навеску тетрабората натрия по формуле (15) :
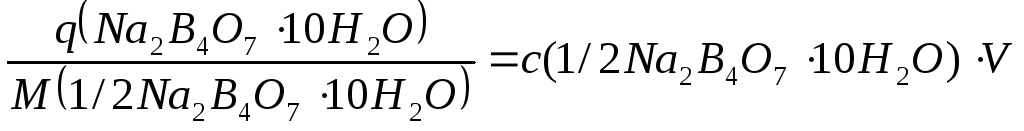
q =0,1500.0,5.190,7 = 14,3025 г.
О т в е т : для приготовления раствора требуется 14,3025 г тетрабората натрия.
З а д а ч а 2. Рассчитать навеску дихромата калия, необходимую для приготовления 250 см3 раствора с молярной концентрацией эквивалента 0,0500 моль/дм3.
Р е ш е н и е. 1) Вычисляют фактор эквивалентности и молярную массу эквивалента К2Cr2O7
Восстановление дихромата калия, являющегося стандартным веществом в методе йодометрии, протекает по реакции :


