ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 128
Скачиваний: 0
СОДЕРЖАНИЕ
Последовательность выполнения операций:
2.2. Примеры расчёта параметров равновесных гомогенных систем
2.3. Примеры расчёта параметров равновесных гетерогенных систем
2.4. Задания контрольной работы № 1.
3.1. Примеры расчётов в гравиметрическом методе
3.2. Примеры расчётов в титриметрическом методе
В 100 г раствора содержится 30 г
2.2. Примеры расчёта параметров равновесных гомогенных систем
П р и м е р 1. Вычислить pH раствора серной кислоты с молярной концентрацией вещества эквивалента 0,05 моль/дм3 (считая кислоту сильной по обеим ступеням диссоциации).
Р е ш е н и е. Сильные кислоты и сильные основания в разбавленных водных растворах диссоциируют полностью. Следовательно, для сильных кислот
[H+] = скисл, откуда (по определению рН):
рН = - lg[H+] = - lg cкисл. (1)
рН = - lg 0,05 = 1,3
О т в е т : рН = 1,3 .
Пример 2. Рассчитать молярную концентрацию ионов OH- в растворе с pH = 12,5.
Р е ш е н и е. Расчёт проводят с учетом ионного произведения воды:
pH + pOH = 14 (2)
pOH = 14 - pH = 14 - 12,5 = 1,5
pOH = - lg[OH-] (по определению pOH);
[OH-] = 10-1.5 = 10-2+0.5 = 3,2.10-2 .
О т в е т: c(OH-) = 3,2.10-2 моль/дм3.
Пример 3. Вычислить pH раствора, содержащего в 1 дм3 0,2г гидроксида натрия.
Р е ш е н и е. Молярная масса гидроксида натрия M(NaOH) =40г/моль; количество вещества, содержащего в 1 дм3 раствора, равно m/M(NaOH) = 0,05 моль, следовательно, молярная концентрация раствора с(NaOH) = 0,05 моль/дм3.
Для растворов сильных оснований pOH = - lg c(осн.) (3)
pOH = -lg c(NaOH) = -lg 0,05 = 1,3; откуда,
исходя из формулы (2) pH = 14 - 1,3 = 12,7.
О т в е т : pH = 12,7.
Пример 4. Рассчитать pH 0,1 моль/дм3 раствора уксусной кислоты.
Р е ш е н и е. Применяем формулу для расчёта pH раствора слабой кислоты
pH = 1/2pKкисл. - 1/2.lg cкисл (4)
По справочнику находим Ккисл = 1,86.10 ,pKкисл. = 4,76.
Подставив числовые значения в формулу (4),находим
pH =1/2.4,76 - 1/2.lg 0,1 = 2,38 + 0,50 = 2,88.
О т в е т : pH = 2,88
Пример 5. Рассчитать равновесные концентрации ионов HCOO- и H+ в растворе с общей концентрацией муравьиной кислоты 4,6г/дм3.
Р е ш е н и е. В справочнике K(HCOOH) = 1,84.10-4 .
Согласно стехиометрии ионизации кислоты
HCOOH = HCOO- + H+ , [H+] = [HCOO-].
Вкладом равновесия ионизации воды пренебрегаем и применяем уравнение (4)
в
форме
![]()
Вычислив молярную концентрацию кислоты с(НСООН)=m(HCOOH)/M(HCOOH)=4,6/46=0,1 моль/дм3, рассчитывают:
[H+]
= [HCOO-]
=
![]() = 4,2.10
моль/дм3
= 4,2.10
моль/дм3
О т в е т : [H+] = [HCOO-] = 4,2.10 моль/дм3
Пример 6. Вычислить рН 0,01 моль/дм3 раствора гидроксида аммония.
Р е ш е н и е. Для расчёта рН раствора слабого основания применяют формулу
рН = 14 - 1/2рКосн. + 1/2.lg cосн (5)
По справочнику рК(NH4OH) = 4,75 ;
рН = 14 - 1/2.4,75 + 1/2.lg0,01 = 14 - 2,37 - 1 = 10,63
О т в е т : рН = 10,63 .
Пример 7. Вычислить рН 0,1 моль/дм3 раствора СН3COONH4.
Р е ш е н и е. Расчет производится по формуле для вычисления рН растворов солей, гидролизующихся по катиону и аниону:
pH = 1/2pK(H2O) + 1/2pKкисл. - 1/2pKосн (6)
Константы ионизации кислоты и основания, образующих соль, находят по справочнику: K(CH3COOH) = 1,74.10-5 ;
K(NH4OH) = 1,76.10-5
Следовательно, pH = 1/2.14 + 1/2.4,76 - 1/2.4,75 = 7,005
О т в е т : рН = 7,005
Пример 8.Рассчитать константу гидролиза (Кгидр),степень гидролиза
(h) и pH 0,1 моль/дм3, раствора роданида аммония.
Р е ш е н и е. NH4SCN -соль, образованная сильной кислотой и слабым основанием. К(NH4OH) = 1,76.10-5.
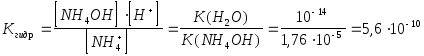
Степень гидролиза
![]()
pH раствора соли , гидролизующейся по катиону, рассчитывается по формуле :
pH = 1/2pK(H2O) - 1/2pKосн - 1/2lg cосн (7)
Следовательно, pH = 1/2.14 - 1/2.4,75 - 1/2lg 0,1 = 5,12 .
О т в е т : Kгидр.= 5,6.10-10 ;h = 7,4.10-5 или 0,0074 % ; pH = 5,12 .
Пример 9. Вычислить рН ацетатной буферной смеси, содержащей по
0,1 моль/дм3 СH3COOH и CH3COONa .
Р е ш е н и е. В общем виде уравнение для расчёта рН буферной смеси, состоящей из слабой кислоты и её соли, имеет вид :
pH = pKкисл. - lg(cкисл/ссоли). (8)
Для уксусной кислоты рКкисл = 4.76 ; следовательно,
рН = 4,76 - lg(0,1/0,1) = 4,76 .
О т в е т : pH = 4,76 .
Пример 10. Как изменится рН аммонийной буферной смеси, содержащей по 0,1 моль в 1 дм3 NH4OH и NH4Cl, при добавлении к 1 дм3 смеси 0,01 моль HCl .
Р е ш е н и е. Применяется формула для расчёта рН основной буферной смеси :
pH = 14 - pKосн + lg(cосн/ссоли) (9)
До прибавления соляной кислоты рН раствора
рН = 14 - 4,75 + lg(0,1/0,1) = 9,25
При добавлении 0,01 моль HCl c(NH4OH) уменьшается эквивалентно добавленной HCl до 0,09 моль/дм3, с(NH4Cl) увеличивается до 0,11моль/дм3 .
рН = 14 - 4,75 + lg(0,09/0,11) = 9,15; ‑pH = 9,25 - 9,15.
О т в е т : pH уменьшится на 0,1 .
Пример 11. Какова буферная ёмкость ацетатного буферного раствора по NaOH, содержащего по 0,1 моль/дм3 компонентов.
Р е ш е н и е. pH ацетатного буферного раствора указанного состава равен 4,76 (cм. пример 9). По определению буферной ёмкости рН раствора при добавлении NaOH должен увеличиться на 1. Это происходит за счёт изменения соотношения концентрации компонентов буферной смеси, которые увеличиваются или уменьшаются эквивалентно количеству добавленного NaOH (моль). Это количество, являющееся буферной ёмкостью, обозначим за Х. Тогда, в соответствии с формулой (8) :
lg(c(CH3COOH) - X)/(c(CH3COONa) + X) = -1
Отсюда (с(СH3COOH) - X)/(c(CH3COONa + X) = 10-1 = 0,1. Решая уравнение относительно Х, находим Х = 0,082 моль.
О т в е т : буферная ёмкость раствора по NaOH равна 0,082 моль .
2.3. Примеры расчёта параметров равновесных гетерогенных систем
П р и м е р 1. Вычислить произведение растворимости гидроксида магния, если растворимость его в 1 дм3 воды равна 0,0120 г.
Р е ш е н и е. Находим молярную концентрацию Mg(OH)2
Молярная масса гидроксида магния M(Mg(OH)2) =58,34 г/моль.
Поэтому
58,34 г в 1 дм3 раствора - 1 моль/дм3
0,012 г в 1 дм3 раствора - Х моль/дм3
Х = 0,012.1/58,34 = 2,06.10 моль/дм3.
При диссоциации гидроксида магния из каждой молекулы образуется один ион магния и два гидроксид-иона, следовательно, их концентрации:
[Mg2+] = [Mg(OH)2] = 2,6.10-4 моль/дм3;
[OH-] = 2[Mg(OH)2] = 2.2,6.10-4 моль/дм3.
Произведение растворимости находим по приближённой формуле (10): ПР(Mg(OH)2) = [Mg2+].[OH-]2 (10)
ПР(Mg(OH)2) = 2,06.10-4.(4,12.10-4)2 = 35.10-12 = 3,5.10-11 .
О т в е т : ПР(Mg(OH)2) = 3,5.10-11 .
П р и м е р 2. Вычислить растворимость PbCl2 в воде, если ПР(PbCl2) = 2,4.10-5 .
Р е ш е н и е. Уравнение ионизации соли PbCl2 = Pb2+ + 2Cl- .
Mолярные концентрации соли и ионов обозначим через X:
[PbCl2 ] = X; [Pb2+ ] = X; [Cl-] = 2X.
Подставляем молярные концентрации ионов в уравнение (10) :
ПР(PbCl2 ) = [Pb2+].[Cl-]2 =2,4.10-5 = X(2X)2 = 4X2
![]() моль/дм3
моль/дм3
Молярная масса PbCl2 = 278,13 г/моль; отсюда его растворимость равна
S(PbCl2) = 3,9.10-2.278,13 = 10,86 г/дм3
О т в е т : S(PbCl2) = 10,86 г/дм3.
П р и м е р 3. Выпадет ли осадок, если смешать 30 см3 0,003 моль/дм3 раствора К2CrO4 и 20 см3 0,0002 моль/дм3 раствора AgNO3 (ПР(Ag2СrO4)=8,8.10-13 - справочная величина)?
Р е ш е н и е. Рассчитаем концентрации веществ в растворе после смешивания. Зная, что концентрации растворов обратно пропорциональны их объёмам, т.е.
с(K2CrO4)1/c(K2CrO4)2 = V(K2CrO4)2/V(K2CrO4)1
где подстрочные индексы 1 и 2 обозначают концентрации и объёмы растворов до и после смешивания, соответственно находим:
с(K2CrO4) = 30.0,003/50 = 1,8.10-3 моль/дм3;
c(K2CrO4) = 20.0.0002/50 = 0,8.10-4 моль/дм3.
Концентрации ионов соответственно равны :
[CrO42-] = 1,8.10 моль/дм3; [Ag+] = 0,8 моль/дм3 ,
отсюда ПР(Ag2CrO4) = [Ag+]2.[CrO42-] = 8,8.10-13 .
Произведение реальных концентраций ионов в растворе (2)
[Ag+]2 .[CrO42-] = (0,8.10-4)2.1,8.10-3 = 1,22.10-11
превышает произведение растворимости, следовательно, осадок выпадает.
О т в е т : осадок выпадает.
2.4. Задания контрольной работы № 1.
З А Д А Н И Е № 1.
1. Дайте определение понятиям "качественная реакция", "селективность реакций", "чувствительность реакции" (предел обнаружения). Какие реакции называются общими, специфическими, частными?
2.Составьте уравнения реакций в ионной и вещественной формах:
а) кислотно-основного;
б) окислительно-восстановительного (в кислой среде);
в) комплексообразовательного взаимодействий исходных веществ (Y) с реагентами (Z) (табл.1).
Таблица 1
Варианты задания № 1
|
Тип ре- ак |
Исходное вещество (Y) |
||||||||||
|
ции |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
а б в |
HSCN HCOOK CuSO4 |
H2SO4 AsH3 CdSO4 |
Na3HPO4 TiCl3 HgCl2 |
HNO3 Na2S AgF2 |
CH3COOH Na2C2O4 Cu(NO3)2 |
HCOOH HCOOH CoCl2 |
NaHCO3 H2C2O4 NiSO4 |
H3PO4 HCN AgNO3 |
H2C2O4 KCN ZnCl2 |
HClO4 CH3CHO CoSO4 |
|
|
Реагенты (Z) |
|||||||||||
|
а б в |
NaOH HClO NH3 |
NH4OH NaClO4 KSCN |
Ca(OH)2 K2Cr2O7 Na2S2O3 |
KOH H2O2 NaCN |
Ba(OH)2 KMnO4 NaH4SCN |
RbOH HNO3 NH4CN |
LiOH KClO3 NH3 |
KOH Cl2 KCN |
NaOH HBrO NaSCN |
NH4OH O2 NH4OH |
|

