ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 109
Скачиваний: 0
СОДЕРЖАНИЕ
Последовательность выполнения операций:
2.2. Примеры расчёта параметров равновесных гомогенных систем
2.3. Примеры расчёта параметров равновесных гетерогенных систем
2.4. Задания контрольной работы № 1.
3.1. Примеры расчётов в гравиметрическом методе
3.2. Примеры расчётов в титриметрическом методе
В 100 г раствора содержится 30 г
Cr2O72- + 14H+ + 6е = 2Cr3+ + 7H2O
Поскольку в полуреакции участвует 6 электронов, то f= 1/6 и
M(1/6 К2Cr2O7) = 1/6M(К2Cr2O7) = 1/6.294,18 = 49,03 г/моль.
2) Рассчитаем навеску К2Cr2O7 по формуле (15) :
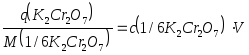
q = 0,0500.0,250.49,03 = 0,6129 г.
О т в е т : для приготовления раствора требуется 0,6129 г дихромата калия.
З а д а ч а 3. Вычислить объём раствора азотной кислоты плотностью р=1,180 г/см3, необходимый для приготовления 3 дм3 раствора с молярной концентрацией эквивалента приблизительно 0,20 моль/дм3.
Р е ш е н и е. 1) Рассчитывают массу безводной азотной кислоты, требующуюся для приготовления 3 дм3 раствора с молярной концентрацией эквивалента 0,20 моль/дм3.
F(HNO3) = 1 , M(1/1HNO3) = M(HNO3) = 63 г/моль.
 c(1/1HNO
).V(дм3)
c(1/1HNO
).V(дм3)
m(HNO3) = 0,20.3.63 = 37,8 г.
2) По плотности раствора HNO3 находят в справочнике массовую долю азотной кислоты. Раствор с массовой долей 30 % масс. имеет плотность 1,18 г/см3. Это значит, что в 100 г раствора содержится 30 г HNO3.
3) Рассчитывают, в каком количестве 30% масс. раствора содержится 37,8 г безводной азотной кислоты. Для этого составляют пропорцию :
В 100 г раствора содержится 30 г
В Х г 37,8 г
4) Рассчитывают объём раствора с массовой долей HNO3 - 30 % масс.
![]()
О т в е т : Необходимый объём раствора HNO3 равен 106,8 см3.
З а д а ч а 4. Сколько граммов H2SO4 содержится в 500 см3 раствора, если на титрование 25,00 см3 этого раствора расходуется 20,25 см3 раствора NaOH c молярной концентрацией эквивалента 0,1150 моль/дм3 ?
Р е ш е н и е. 1) Выясняют метод анализа и записывают реакцию. Эта задача относится к методу кислотно-основного титрования :
H2SO4 + 2NaOH = Na2SO4 + 2H2O
f(H2SO4) = 1/2, M(1/2 H2SO4) = 1/2M(H2SO4) = 49,04 г/моль.
2) Рассчитывают молярную концентрацию эквивалента H2SO4, применяя закон эквивалентов (количество моль эквивалента серной кислоты должно равняться количеству моль эквивалента гидроксида натрия) :
n(1/2 H2SO4) = n(1/1NaOH);
c(1/2 H2SO4) . V(H2SO4) = c(1/1NaOH) . V(NaOH)
откуда
с(1/2 H2SO4)
=
![]() = 0,09315 моль/дм3
= 0,09315 моль/дм3
-
Находят титр раствора серной кислоты :
![]()
4) Вычисляют массу H2SO4 в 500 см3 раствора :
m(H2SO4) = T(H2SO4) . V = 4,568.10-3 . 500 = 2,2840 г.
О т в е т : в 500 см3 раствора содежится 2,2840 г H2SO4.
З а д а ч а 5. Рассчитать массу перманганата калия в растворе, если после его замещения на I действием избытка KI и H2SO4 на титрование затрачено 24,50 см3 раствора тиосульфата натрия, титр которого равен 3,971.10-2 г/см3.
Р е ш е н и е. Выясняют метод анализа и составляют реакции. Эта задача относится к редоксиметрическому титрованию (йодометрия), которое проводят по методу замещения. При взаимодействии KMnO4 c раствором, содержащим избыток КI и H2SO4 ,происходит замещение KMnO4 эквивалентным количеством I :
 2
MnO4-
+ 8H+
+ 5е
= Mn2+
+ 4H2O
2
MnO4-
+ 8H+
+ 5е
= Mn2+
+ 4H2O
5 2I- - 2е = I2
2MnO4- + 10I- + 16H+ = 2Mn2+ + 5I2 + 8H2O
n(1/5KMnO4) = n(1/2I2)
Затем выделившийся йод оттитровывают раствором Na2S2O3 :
1 I2 + 2е = 2I-

1 2S2O32- - 2е = S4O62-
n(1/2I2) = n(1/1Na2S2O3)
Количество моль эквивалента KMnO4 равно количеству моль эквивалента I, а последнее - количеству моль эквивалента Na2S2O3 :
n(1/5KМnO4) = n(1/2I2) = n(1/1Na2S2O3)
При данном определении перманганат калия и тиосульфат натрия непосредственно друг с другом не реагируют, однако их количества эквивалентны, откуда
![]() c(1/1
Na2S2O3).V(Na2S2O3)
c(1/1
Na2S2O3).V(Na2S2O3)
f(KMnO4) = 1/5, M(1/5KMnO4) = 1/5M(KMnO4) = 1/5.158 = 31,6г/моль
2) Вычисляют молярную концентрацию эквивалента раствора тиосульфата натрия по формуле :
![]()
f(Na2S2O3) = 1, M(1/1 Na2S2O3) = M(Na2S2O3).
Поскольку в аналитической практике, как правило, применяют пентагидрат тиосульфата натрия, M(Na2S2O3.5H O) = 248,19 г/моль.
с(1/1
Na2S2O3)
=
![]() = 0,1600 моль/дм3.
= 0,1600 моль/дм3.
3) Рассчитывают массу перманганата калия по формуле :
m(KMnO4) = c(1/1 Na2S2O3).V(Na2S2O3).M(1/5KMnO4)
m(KMnO4) = 0,1600.0,245.31,60 = 0,1238 г.
О т в е т : масса перманганата калия равна 0,1238 г.
З а д а ч а 6. Вычислить массовую долю кальция в навеске массой 0,3959 г, если на её титрирование после растворения израсходовано 15,00 см3 раствора ЭДТА с молярной концентрацией эквивалента 0,1000 моль/дм3.
Р е ш е н и е. 1) Эта задача относится к методу комплексонометрического титрования, которое проводят по методу отдельно взятых навесок :
Ca2+ + H2Y2- = CaY2- + 2H+
f(Ca2+) = 1, M(1/1Ca2+) = M(Ca2+)
n(Ca2+) = n(Na2H2Y)
2) Вычисляют массу кальция, содержащуюся в навеске :
![]() c(1/1Na
H Y).V(Na
H Y)
c(1/1Na
H Y).V(Na
H Y)
m(Ca2+) = 0,1000.0,0150.40,08 = 0,0600 г.
3) Рассчитывают массовую долю кальция в навеске :
0,3959 г 100 %
0,0600 г X %
![]()
О т в е т : массовая доля кальция в навеске составляет 15,2 %.
3.3. Задания контрольной работы n 2
З А Д А Н И Е N 1
0. В чём сущность гравиметрического метода анализа, его достоинства и недостатки. Приведите схему необходимых операций в методе осаждения. Опишите определение кристаллизационной воды в хлориде бария.
1.Перечислите требования, предъявляемые к осадкам, осаждаемой и гравиметрической (весовой) формам. Опишите определение серы в растворимых сульфатах.
2.Объясните правило выбора осадителя, его количества и требования, предъявляемые к нему. Опишите определение хлора в растворимых хлоридах.
3.Обоснуйте условия образования и свойства кристаллических осадков. Опишите гравиметрическое определение железа(III).
4.Перечислите условия образования и свойства аморфных осадков. Опишите гравиметрическое определение алюминия.
5.Приведите различные факторы, влияющие на растворимость осадков. Опишите гравиметрическое определение кальция.
6.Дайте характеристику явлениям соосаждения и окклюзии. Опишите гравиметрическое определение натрия и калия.
7.Перечислите правила определения осадков(фильтрование) и их промывания. Опишите гравиметрическое определение кальция и магния.
8.Приведите сравнительную характеристику гравиметрического и титриметрического методов анализа. Опишите гравиметрическое определение бария.
9.Перечислите способы очистки осадков от различных загрязнений в гравиметрическом анализе. Опишите определение диоксида углерода в карбонате кальция.
З А Д А Н И Е № 2
Вычислите массу навески анализируемого вещества (Z), если известны степень его чистоты (Х), гравиметрическая форма (Z) и её масса (Y) (табл.11).
Таблица 11
Варианты задания 2
|
X Y |
Z |
Y |
X |
|
|
Z |
Определяемое вещество |
Гравиметри- ческая форма |
Масса гравиметрической формы , г |
Степень чистоты анализируемого вещества, % |
|
0 |
Na2S2O3 |
BaSO4 |
0,2445 |
99 |
|
1 |
Ca3(PO4)2 |
CaO |
0,3050 |
98 |
|
2 |
H3PO4 |
Mg2P2O7 |
0,3965 |
97 |
|
3 |
Pb2O2 |
PbSO4 |
0,4545 |
96 |
|
4 |
Fe2O3 |
Fe2O3 |
0,5865 |
95 |
|
5 |
K2O |
K2PtCl3 |
0,6375 |
94 |
|
6 |
Ag2O |
AgCl |
0,7050 |
93 |
|
7 |
CuO |
Cu(SCN)2 |
0,7995 |
92 |
|
8 |
Na2O |
NaCl |
0,8875 |
91 |
|
9 |
BaCl2 |
BaCrO4 |
0,9520 |
90 |


