Файл: Осы масаттар негізінде арнаулы курс алдында мынадай міндеттер тр.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 37
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ТҮСІНІК ХАТ
Химия курсының теориялық материалын сәтті игертудің тиімді жолдарының біріне химиядағы типтік есептерді шығару дағдыларын қалыптастыру мен меңгерту жатады. Болашақта химия және биология мамандықтарына даярлайтын ЖОО-на түсем деушілерге, әртүрлі типтегі химиялық есептерді шығару әдістемесін игерудің пайдасы орасан. Тиісті мамандықтар бойынша ЖОО-на түсем деуші абитуриенттерге және студенттерге типтік есептерді көптеп шығарту қолға алынуда.
Күрделі есептерді шығаруда химияның теориялық курсын жақсы білу жеткіліксіз, егер де есеп шығару дағдылары қалыптаспаса.Өкінішке орай, мектептегі химия курсын оқытуда есептер шығаруға тиісті деңгейде сағаттар бөлінбеген.Жалпы алғанда, есептерді шығарудың өзіндік реті, шығару әдістемесі болады.Сондықтан да, қиындық деңгейлері қарапайым типтік есептерді шығаруды меңгерту арқылы, қиындық деңгейлері күрделі типтік есептерді шығару дағдыларын қалыптастыру қажет.
Мақсаты:
· химиялық ғылымның саласындағы білімдерін игеру;
· оқушылардың химия пәнінен алған теориялық білімдерін бекіту;
· оқушылардың ойлау қабілеттерін дамыту;
· тәжірибелік білімнін тәсілдерін игеру;
· оқушылардың қызығушылығын, парасаттылық және шығармашылық қабілеттерін даму;
· білім алған кезінде оқушылардың шығармашылық қатынастарын тәрбиелеу
Осы мақсаттар негізінде арнаулы курс алдында мынадай міндеттер тұр:
· ғылыми деректерден, ұғымдардан, заңдармен теориядан тұратын химия ғылымының негізін меңгеру;
· химияның ғылыми маңызын ашу арқылы оқушыларға дидактикалық көзқарас қалыптастыру;
· оқушылардың логикалық ойлау қабілетін дамытуға жасампаздық іс-әрекет экологиялық мәдениет қалыптасуына жәрдемдесу.
Оқушылардан күтілетін нәтижелер
· есеп шығаратың дағдыларын бекіту;
· шығармашылық тапсырмаларды орындау;
· құрбылармен қатынасуға, өз пікірін қорғау қабілеттерге үйрену.
Оқу процесін ұйымдастыру
Курс бойынша оқу процесті ұйымдастыруда келесі негізгі принциптер енгізілді:
-
Курсқа қызығушылықты арттыру; -
Белсенді қатысу; -
Еркіндік және диалогқа дайындық; -
Өз ойына сеніммен қарау.
Әдістер:
-
Зерттеушілік – ізденіс; -
Есептер шығару, талдау
Жұмыс түрлері:
-
теориялық сабақтар (дәрістер), есептер шығару.
Бағалау барасы:
-
Материалдың дұрыстығы, әрі сапалы баяндалу; -
Ұғымдар мен заңдылықтардың толық ашылуы; -
Химиялық терминдердің , формулалардың дәл қолданылуы; -
Дербес жауап; -
Материалдық логика; -
Дәлелді баяндау және өзіндік икемділік.
Бағдарламаның мазмұндық бөлігі
| № | Мазмұны | Сағат саны | мерзімі |
| 1 | Моль тақырыбына есептер шығару | 1 | |
| 2 | Мольдік масса | 1 | |
| 3 | Молярлық көлем | 1 | |
| 4 | Заттың эквивалентті массасы | 1 | |
| 5 | Химиялық теңдеулер бойынша есептеулер әдістемесі | 1 | |
| 6 | Химиялық типтік есептер | 1 | |
| 7-8 | Химиялық теңдеулер бойынша есептеулер алгоритмі (бейметалдар) | 1 | |
| 9-10 | Электролиттік ертінділер (типтік есептер) | 1 | |
| 11-12 | Судың иондық көбейтіндісі. Сутектік көрсеткіш | 1 | |
| 13-14 | Электролит ертінділеріндегі алмасу реакциялары. Тұздар гидролизі | 1 | |
| 15-16 | Заттар массасының сақталу заңы | 1 | |
| 17 | Ертінділер концентрациясын көрсету жолдары | 1 | |
Қолданылатын әдебиеттер тізімі
1. Беляева И.И., Сутягина Е.И., Шелепина И.А. «Задачи и упражнения по общей и неорганической химий». Москва «Просвещение» 2002 ж.
2. КузьменкоН.Е:, Еремин В.В. «2500 задач по химии с решениями». Москва «Оникс 21 век», «Мир и образование» 2002 ж.
3. Врублевский А.И. «1000 задач по химии с цепочками превращений и контрольными тестами» Минск ООО «Юнипресс» 2003 ж.
4. Момынов Ө. «Органикалық химиядан шығарылған есептер жинағы» Шымкент, 2006 ж
5. «Химия» 8-сынып оқулығы. Н.Нұрахметов, Қ.Сарманова, К.Жексембина.
6. «Химия» есептер мен жаттығулар жинағы. Ә.Е.Темірболатова.
7. Ю.М.Лабий. «Решение задач по химии с помощью уравнений и неравенств»
8. Г.И.Штремплер, А.И.Хохлова. «Методика решения расчетных задач по химии» 8-11класс.
9. Қ. Бекишев. Химия есептері.- Алматы: РБК, 2001.
10. Қ. Бекишев. Химия олимпиада есептері.- Алматы: Рауан, 2001.
7. А.С. Егоров. Все типы расчетных задач по химии для подготовки к ЕНТ.
1 – сабақ.
Сабақтың тақырыбы: Зат мольшері, Моль, Авогадро саны, Молярлық (мольдік) масса.
Сабақтың мақсаты:
Білімділік: Зат мөлшерінің өлшем бірлігі – моль туралы, Авогадро саны жөнінде ұғым қалыптастыру. Заттың берілген өлшемі бойынша құрылымдық бөлшектердің санын анықтауға үйрену.
Дамытушылық: Молярлық масса ұғымын, заттың молярлық массасын есептеп шығару білігін қалыптастыру. Масса, зат мөлшерінің өлшем бірлігі, молярлық масса деген ұғымдарды өзара байланыстыра отырып, есеп шығаруға үйрету. Молярлық және салыстырмалы молекулалық массалар сандық мәні бойынша тең болатындығын түсіндіру.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Сабақтың түрі: аралас сабақ. Пән/қ байланыс: физика, биология.
Құрал жабдықтар: зат мөлшері бір моль болатын металлдармен бейметаллдар үлгілері (күкірттің, темір ұнтағының, мырыштың, )
Тірек біліммен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Жаңа материалды оқыту. Мұғалім өткен сабақтан байланыстыру мақсатымен оқушыларға бірнеше сұрақ қояды:
1. Заттың құрам тұрақтылығы дегеніміз не?
2. Темір сульфидінде темір мен күкірттің тұрақты масса қатынасы қанда?
Оқушыларға ұнтақтар 4 г. күкіртте күкірттің қанша атомы болса, 7 г. темірде темірдің сонша атомы болатынын түсіндіреді. Демек, әрбір темір атомы күкірттің бір атомымен қосылысады деген тағы бір тұжырымды оқушы өз бетімен жасайды.
Бұрын алған білімін еске түсіріп, талдау нәтижесінде жасаған қорытындыларына сүйене отырып, мұғалім заттардың атомдары мен молекулаларының қажетті санын алу іс жүзіне мүмкін еместігін айтады. Сондықтан химияда «зат мөлшері» деген физикалық шама қолданылады.
Ал зат мөлшері сол заттың құрылымдық бөлшектерінің санымен анықталады, яғни атом, молекула немесе басқа бөлшектер саны. Зат мөлшерінің өлшем бірлігі – моль. Моль–берілген заттың құрылымдық бөлшектері 12г көміртегіндегі атом санына сәйкес келетін зат мөлшері. ν (ню) әрпімен белгіленеді, құрылымдық бөлшектер саны Na әрпімен белгіленеді.
Заттың керекті мөлшерін қалай өлшеп алуға болады?
Осы жерде молярлық массаны пайдаланатындығын айтып, оқушыларды сабақтың мақсатымен таныстыру. Зат мөлшерін моль арқылы өрнектеген сияқты молярлық масса зат массасын грам арқылы көрсетеді. Демек, мұғалім «Заттың молярлық массасы М зат массасының зат мөлшеріне қатынасына тең шама» деген анықтаманы айтып, оқушылардың дәптеріне жазғызады.
Молярлық масса г/мольмен, яғни граммен алынған мольмен өрнектеледі: М=m / ν Мысалы:
1) M(H2)= 2 г/моль; 2) M(O2) =32 г/моль; 3) M(H2O) =18 г/моль
Оқушылардың өздігінен шығаруына берілетін есептер:
-
Массасы 112г темір неше моль болады? -
Массаса 132г көміртегі(IV) оксиді неше моль болады? -
Массасы 272г мырыш хлориді неше моль болады? -
Мөлшері 0,3 моль көміртегі(IV) оксидінің массасын есептеп шығарыңдар; -
Мөлшері 0,2 моль мыс (ІІ) оксидінің массасын есептеп шығарыңдар; -
Мөлшері 0,5 моль судың массасын есептеп шығарыңдар;
Оқушылардың шығарған есептерін тексеріп, қателерін түзеткеннен кейін, жаңа тақырып бойынша қорытынды жасалады.
Сабақ соңында төмендегі сұрақтар көмегімен оқушыларда жаңадан қалыптастырылған ұғымдарды бекітуге болады:
1. Заттың молярлық массасы дегеніміз не?
2. Заттың молярлық массасының өлшем бірлігі не?
3. Қай формуланың көмегімен заттың молярлық массасын, массасын, мөлшерін анықтауға болады? Зат мөлшерінің өлшем бірлігі не?
4. Зат мөлшері қалай белгіленеді?
5. a) ν (C) = 4 моль деген жазу нені білдіреді?
б) ν (H2O)=2 моль деген жазу нені білдіреді?
6. Үш молекула су қанша моль болады?
2 - сабақ
Сабақтың тақырыбы: Мольдік масса. Молекулалардың өлшемі мен массасы. Молекулалар саны. Зат мөлшері.
Сабақтың әдісі: Түсіндірмелі баяндау, сұрақ-жауап.
Сабақтың көрнекілігі: интерактивті тақта, проектор, слайд
Пәнаралық, пәнішілік байланыс: физика
Сабақ барысы.
І. Ұйымдастыру кезеңі
ІІ. Жаңа сабақты түсіндіру
IІІ. Жаңа сабақты бекіту
ІV. Қорытындылау
І Ұйымдастыру кезеңі.
а) оқушыларды түгендеу
Жаңа сабақ түсіндіру.
Молекулалардың негізгі сипаттамаларының бірі олардың өлшемі мен массасы болып табылады.
Молекулалар мен атомдардың өлшемдері өте кіші болғандыөтан оларды тек салыстыру жолымен ғана көрсетуге болады.
Молекулалар өлшемін бағалау үшін неміс физигі В Рентген мен ағылшын физигі Д Релей тәжірибе жүргізді.
Молекулалардың өлшемі өте кіші болғандықтан, олардың саны кез келген денеде өте көп болады. Мысалы 1см3 ауада қалыпты атмосфералық қысым мен 00 С температура кезінде 2,7 *1019 молекулалар болады. Массасы 1г су тамшысындағы молекулалардың жуық саны – 3,7*1022 . сонда судың бір молекуласының массасы:
Макраскопиялық денелердегі молекулалар саны сияқты үлкен сандарды немесе молекула массасы сияқты өте аз сандарды тәжірибеде пайдалану ыңғайсыз. Сондықтан қолайлы болу үшін атомдардың саны мен массаларын көрсеткенде олардың салыстырмалы мәнін пайдадану қабылданған.
Халықаралық келісімге сай барлық молекулалардың массаларын көміртек атомы массасының 1/12 бөлігімен салыстырады.
Заттардың Мr салыстырмалы массасы деп берілген заттың молекуласының m0 массасының көміртек атомының m0 C массасының 1/12 бөлігіне қатынасын айтады.
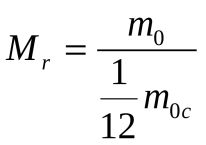
Барлық химиялық элементтердің атомдарының салыстырмалы массалары Д.И Менделеевтің периодтық кестесінде көрсетілген.
Егер зат атомдардан есем молекулалардан тұрса онда оның салыстырмалы молекулалық массасы молекуланы түзуші элементтердің салыстырмалы атомдық массаларының қосындысына тең. Мысалы, Н2 О судың салыстырмалы молекулалық массасы мынаған тең: (1*2+16=18).
Кейбір есептерді шешу үшін берілген денедегі барлық молекулалар мен атомдардың санын білу маңызды. Берілген денедегі барлық атомдар мен молекулалардың салыстырмалы саны зат мөлшері деп ататын физикалық шамамен сипатталады.
