Файл: Осы масаттар негізінде арнаулы курс алдында мынадай міндеттер тр.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 38
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Заттың мөлшері деп берілген денедегі N молекулалар санының 12г көміртектегі NA атомдар санына қатынасын айтады:
=
NA – Авагадро тұрақтысы. Оны 1811 жылы итальян физигі әрі химигі А. Авагадро анықтаған соның құрметіне осылай аталған.
NA = 6,02*1023 моль -1
Зат мөлшерінің бірлігіне 1 моль алынған.
Моль - 12г көміртекте қанша атом болса, сонша бөлшектері бар заттың мөлшері.
Салыстырмалы молекулалық массамен қатар физика мен химияда М молярлық масса ұғымы кеңінен пайдаданылады.
Молярлық масса деп 1 моль мөлшерінде алынған заттардың массасын айтады. Өлшем бірлігі 1 кг/моль.
M=m0 NA
Заттардың молярлық массасы мен оның салыстырмалы молекулалық массасы өзара байланысты. Заттардың молярлық массасының граммен өрнектелген сандық мәні осы заттардың салыстырмалы молекулалық массасына тең.
Молекуланың массасын табу үшін m0 =
Зат мөлшері, зат массасы және молярлық масса арасында мынадай байланыс бар:
m=m0 N= m0 NA =M
денедегі молекула санын зат массасы мен молярлық масса арқылы табуға болады:
N=NA
Жаңа сабақты бекіту
Химиялық диктант
-
____________________________________ деп берілген заттың молекуласының m0 массасының көміртек атомының m0 C массасының 1/12 бөлігіне қатынасын айтады. -
Берілген денедегі N молекулалар санының 12г көміртектегі NA атомдар санына қатынасын__________________________________ айтады.
-
_____________________________деп 1 моль мөлшерінде алынған заттардың массасын айтады. -
Авагадро тұрақтысы мынаған тең: ______________________________________________ -
Зат мөлшері, зат массасы және молярлық масса арасындағы байланыс_______________________________________________________________________
-
1 моль _______________________________________________ өлшем бірлігі.
3 – сабақ.
Тақырыбы: Молярлық көлем. Авагадро заңы. Газдардың салыстырмалы тығыздығы.
Сабақтың мақсаты:
Білімділігі:Оқушыларға интерактивті тақтаны пайдалана отырып химияның негізгі заңдарының бірі Авогадро заңы, сонымен қатар газдардың молярлық көлемі және газдардың салыстырмалы тығыздығы жайлы білім беру
Дамытушылығы:Қатысушылардың формулаларды пайдаланып есеп шығару арқылы ойлау жылдамдығын және ой өрісін дамыту
Тәрбиелілігі:Берілген жаңа тақырыпты түсіндіре отырып оқушыларды қоршаған ортаға деген көзқарасын дамытып,ұжымшылдыққа тәрбиелеу
Сабақтың түрі: жаңа сабақ
Көрнекіліктер: слайд,кесте, т.б
Сабақтың барысы:
І.Ұйымдастыру кезеңі
Заттың молярлық массасы және молярлық көлемі.
Молярлық масса – заттың формулалық бірлігі молінің массасы. Ол заттың массасы мен мөлшері арқылы есептеледі: М = m / n
Молярлық масса г/мольмен өлшенеді. Кез – келген заттың бір молінде құрылымдық бірлігі бірдей саны болса, онда молярлық масса заттың салыстырмалы молекулалық (немесе атомдық) массасына пропорционал:
М = К . Мr
Мұндағы К – 1 г/ мольге тең пропорционалдық коэффициент. 126С көміртегі изотопының Аr = 12, ал атомның молярлық массасы 12 г/ мольге тең.
Демек, екі массаның сан мәні сәйкес келеді де, К=1 тең болады. Олай болса, г/мольмен берілген заттың молярлық массасы сан мәні жағынан салыстырмалы молекулалық( атомдық) массаға тең. Атомарлық сутектің молярлық массасы — 1,008 г / моль, молекулалық сутектікі – 2,016 г/ моль, оттектікі – 31,999 г /мольге тең.
Авогадро заңы бойынша қалыпты жағдайда кез – келген газдың молекулалар саны бірдей болса, олар бірдей көлем алады. Кез – келген заттың 1 молінде бөлшектер саны бірдей. Осыдан, белгілі температура мен қысымда кез – келген газ күйіндегі заттың 1 моль бірдей көлем алады. Қалыпты жағдайда, яғни 101,325 кПа атмосфералық қысымда және 273 К температурада 1 моль газ қандай көлем алатынын есептеуге болады. Мысалы, қалыпты жағдайда 1 л оттегінің массасы 1,43 г тең. Бір моль оттегінің көлемі 32 /1,43 = 22,4 л тең болады.
Демек, молярлық көлем дегеніміз заттың алатын көлемінің зат мөлшеріне қатынасын айтады. Қалыпты жағдайда кез – келген газдың молярлық көлемі 22,4 л/ мольге ( Vn = 22,414 л/мольге) тең.
ІІІ.Жаңа сабақ
Жаңа сабақты түсіндірмес бұрын сендерге бірнеше сұрақ қойғым келеді.
-
Ауаның құрамына қандай газдар кіреді? -
Авагадро санын еске түсіре отырып,ол нещеге тең екенін айталық? -
Молекула дегеніміз не?
Көптеген газдар қалыпты жағдайда газ күйінде болады.Олар ауа құрамына кіретін азот,оттек, т.б газдар.Одан басқа метан.этан сияқты көміртек пен сутектен құралған газдар да бар.Газдардың белгілі бір заңға бағынатынын физикадан білесіңдер.
Қатты заттардан газ тектес заттардың айырмашылығы – оларды сипаттау кезінде массадан гөрі көлем ұғымы жиірек пайдаланылады.Итальяндық ғалым А.Авагадро газдар құрамына кіретін жай заттардың молекуласы екі атомнан тұратынын айтты.Мысалы жай заттар сутек Н
2, оттек О2 және т.б.
Қалыпты жағдайда (қ.ж.),яғни 00С температурада, 1 атмосфералық қысымда (101,325 кПа) кез келген газдың бір молі 22,4л көлем алады.Оны молярлық көлем деп атайды.
Осы есептеулерден көрініп тұрғандай 1 моль газдың көлемі шамамен бірдей екен, оның сандық мәні 22,4 л. Мольдік көлем (Vm) t0С = 00С, р = 1 атм = 101,3 кПа жағдайында анықталған, бұл қалыпты жағдай (қ.ж.) деп аталады.
Бірдей жағдайда алынған газдардың тең көлемдерінде молекула сандары бірдей болады. Бұл - Авогадро заңы. Ол 1811 жылы ашылған.
Химияда тығыздықтан басқа салыстырмалы тығыздық деген түсінік те пайдаланылады.
Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп атайды.
Бір газдың екінші газбен салыстырғандағы тығыздығы олардың молярлық массаларының қатынасындай болады. Салыстырмалы тығыздық сутегі мен ауа бойынша беріледі.
Сонда
М(Н2) = 2 г/моль;
М(ауа) = 29 г/моль
М{х) = 2D(H2); М(х) = 29D(aya), мұндағы х - белгісіз газдың мольдік массасы.
Қалыпты жағдайдағы газдың тығыздығы мына формуламен анықталады:
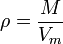
Есеп: Сутегі,оттек,ауаның қ.ж-да тығыздығын есептеңдер
IV.Сабақты бекіту
Химиялық есептеулерде масса, көлеммен қатар зат мөлшері қолданылады. Заттар молекулалардан, атомдардан немесе иондардан тұрады. Заттағы құрылымдық бөлшектердің мөлшерін моль арқылы анықтайды. Зат мөлшерінің өлшем бірлігі – моль болып табылады. Моль дегеніміз массасы 12-ге тең көміртегі атомының 0,012 кг қанша атомдар болса, құрамында сонша құрылымдық бөлшектер – молекулалар, атомдар немесе иондар болатын зат мөлшері.
Моль дегеніміз құрамындағы құрылымдық бірліктердің саны үлкен нақтылықпен анықталған: Практикалық есептеулерде оны 6,02 ∙ 1023 Авагадро саны деп атайды.
Зат мөлшерінің 1 молінің массасы граммен өрнектеледі. Зат массасының зат мөлшеріне қатынасына тең шаманы молярлық масса деп аталады. Бос күйіндегі хлордың СІ2 салыстырмалы молекулалық масса 70,90 тең. Демек, молекулалы хлордың мольдік массасы 70,90 г/моль құрайды. Бірақ, хлор атомының мольдік массасы 2 есе кіші (34,45 г/моль), себебі хлор СІ2 молекуласының 1 молі хлор атомының 2 молін құрайды.
1-мысал. СО2 бір молекуласының массасын граммен өрнектеу.
Шешуі. СО2 молекулалық массасы 44,0 тењ. Демек, СО2 мольдiк массасы 44,0 г/моль. 1 моль СО2 6,02 ∙ 1023 молекуладан құралады. Бұдан бір молекуланың массасын табамыз:
m = 44,0 / (6,02 ∙ 1023) = 7,31 / 1023 г.
Авагадро заңы: бірдей жағдайда (бірдей температура мен қысымда) әр түрлі газдардың бірдей көлемдеріндегі молекулалар саны бірдей болады.
Басқаша айтқанда, кез келген газдың 1 молі бірдей молекула санынан тұрады. Демек, бірдей жағдайда кез келген газдыњ 1 молі қалыпты жағдайда 22,4 л көлем алады. 22,4 л газдардың қалыпты жағдайдағы (0º қысым 101,325 кПа) мольдік көлем деп аталады.
2-мысал. 100ºС температурадан жоғары жабық ыдыстың ішінде сутек пен оттектің эквиваленттік қоспа мөлшерлері бар. Егер қоспа жарылып, содан кейін ыдыстың ішіндегі құрамдарды бастапқы температураға әкелсе, ыдыстың ішіндегі қысым қалай өзгереді?
Шешуі. Сутегі мен оттегін әрекеттестіргенде єр екі Н2 молекуласынан және бір О2 молекуласынан 2 молекула Н2О пайда болады. Реакция нәтижесінде молекуланың жалпы саны 1,5 есе кемиді. Реакция тұрақты көлемде жүреді, ал реакция аяқталғаннан соң ыдыстың ішіндегі заттарды бастапқы температураға алып келеді. Молекула саны 1,5 есе кемиді, сондықтан қысымның да сонша есе азаюына әкеліп соғады.
