Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 182
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.

Потом проводят реакцию с азотной кислотой, наблюдают образование белого осадка.
При взаимодействии с калия йодидом выпадает желтый осадок.
Во время реакции с тиомочевиной и калия пикратом образуются желтые призматические кристаллы.

Обнаружение Zn
Реакция с дитизоном (предварительная). К 0,5 мл минерализата прибавляют 0,25 мл насыщенного раствора тиосульфата натрия, устанавливают рН=4,5-5,0 (по универсальному индикатору) с помощью ацетатного буферного раствора, добавляют 2 капли 0,01 % раствора дитизона в хлороформе и 1 мл хлороформа. Полученный раствор энергично встряхивают. При наличии ионов цинка слой хлороформа окрашивается в розовый или красно-фиолетовый цвет.
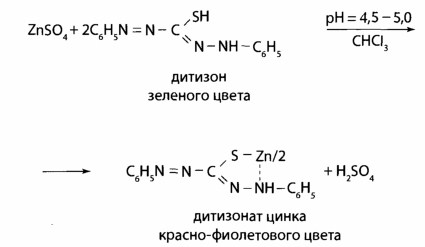

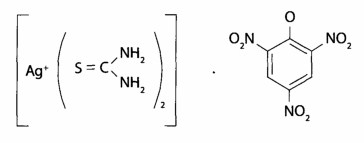
Оценка. Реакцией можно обнаружить в 100 г исследуемого объекта 5 мг цинка. Реакция имеет судебно-химическое значение при отрицательном результате.
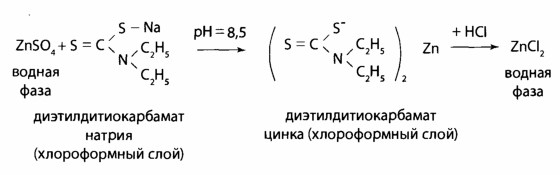
Выделение цинка из минерализата, К 10 мл минерализата добавляют 4 мл раствора калия-натрия тартрата или 20% раствор лимонной кислоты (для маскирования железа), 1 мл насыщенного раствора тиомочевины (или тиосульфата натрия) для маскирования ионов кадмия и меди и доводят pH до 8,5 (по универсальному индикатору) с помощью 10% раствора гидроксида натрия. Смесь взбалтывают с 3 мл 1% раствора диэтилдитио- карбамата натрия и 5 мл хлороформа. Слой хлороформа отделяют, промывают 10 мл воды и встряхивают с 3 мл 1 М раствора хлороводородной кислоты. Водную фазу (реэкстракт), содержащую хлорид цинка, отделяют и исследуют.

Реакция с гексацианоферратом(П) калия. К 1 мл реэкстракта добавляют 10% раствор гидроксида натрия до рН=5 (по универсальному индикатору) и 2 капли 5% раствора гексацианоферрата(И) калия. Образуется осадок или муть белого цвета.


Реакция с сульфидам натрия. К 1 мл реэкстракта прибавляют 10% раствор гидроксида натрия до рН=5 (по универсальному индикатору) и 3-4 капли свежеприготовлешюго 5% раствора сульфида натрия. Образуется осадок или муть белого цвета.
Реакция с тетрароданамеркуроатам аммония. 3-4 капли реэкстракта выпаривают досуха на предметном стекле. Сухой остаток растворяют в капле 10% раствора уксусной кислоты и прибавляют каплю раствора тетрароданомеркуроата аммония. В присутствии ионов цинка образуются бесцветные одиночные клиновидные кристаллы или дендриты

Схема дробного анализа минерализата на «металлические яды»: кадмий, таллий, висмут, стибиум и арсен
Выявление ионов кадмий
КАДМИЙ.
Распространение и применение.
В 1818 году немецкий химик и фармацевт, профессор Теттингенского университета опубликовал подробные сведения о новом химическом элементе – кадмии, который занимает в периодической системе элементов Д.И. Менделеева №48.
Кадмий применяется в промышленности при добыче легкоплавких сплавов, замене висмута в типографическом шрифте или замене олова при эмалировке посуды.
Оксид кадмия, соли кадмия и сплавы используются в производстве сухих никелево-кадмиевых аккумуляторов и батареек, при паянии и изготовлении светящихся красок и пластиковых красителей.
Металлический кадмий используется для изготовления регулировочных стержне в атомных реакторах, потому что хорошо поглощает тепловые нейтроны.
Подверженность воздействию кадмия связана с его использованием в промышленности при производстве сплавов, кадмиевом покрытии металлов. При нагревании , размоле, сварке, спайке содержащих кадмий металлических изделий человек вдыхает пыль и пары, что часто является причиной отравления. В основном люди подергаются воздействию соединениями кадмия при приеме пищи, воды, вдыхании воздуха и при курении сигарет (одна пачка в среднем содержит 1,9 мкг кадмия). Ежедневное потребление кадмия организмом в количестве 2-200 мкг в пересчете на металл, считается нормальным.
Аккумуляция кадмия организмом человека, начиная от рождения, предположительно способствует возникновению гипертонии. Тем более, в 1968 году в научной литературе появилась статья «Кадмий и сердце». В ней говорилось, что служба здравоохранения США обнаружила зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний. Предельно допустимая концентрация для кадмия в воздухе в виде пыли или дыма не должна превышать 0,01 мг/м
3, тем более, что это соединение отнесено к канцерогенным веществам.
Концентрация в крови. Концентрация кадмия в сыворотке крови, у людей которые не подвергаются его воздействию, находится в пределах от 0,5 до 2,0 мкг/л. содержание кадмия в цельной крови вдвое больше. При этом не наблюдалось разницы в зависимости от пола и возраста человека. Содержание кадмия в крови у курящих людей 1,1 мкг/л, а у некурящих – 0,4 мкг/л. Концентрация кадмия у рабочих, подвергавшихся воздействию данным металлом и не имеющих признаков отравления – 9,0 мкг/л. Концентрация в крови у рабочих занятых кадмированием металлов и получением его сплавов в среднем находится в пределах от 1,0 до 113 мкг/л.
Метаболизм и выделение.
Кадмий, попадающий в организм человека при вдыхании пыли, паров, с продуктами, водой, при курении накапливается в легких, печени, почках и медленно выводится с мочой. Постепенное выведение ионов металла связано с наличием в указанных органах малого белка металлотионеина, который в качестве кофактора имеет ион кадмия. Уровень кадмия в почках хорошо коррелируется с возрастом людей. При исследовании трупов людей, которые обрабатывали минералы, содержащие кадмий, уровень металла в печени в среднем составлял 2,0 мг/кг, в почках – 11,7 мг/кг. Содержание кадмия в моче в норме составляет 0,1-0,2 мкг/мл, но этот показатель увеличивается у курящих людей. В случае если концентрация кадмия в рабочей зоне производственных помещений составляет 0,01 мг/м3 его содержание в моче составляет 3,7 мкг/л.
Концентрация кадмия у людей в норме (мг/л или мг/кг)
| | кровь | печень | Корковое в-во почек | жир | моча | Волосы |
| Некурящие | 0,0009 | 1,0 | 13 | 0,03 | 0,0006 | 1,0 |
| курящие | 0,0018 | 1,3 | 24 | 0,04 | 0,0007 | 0,5 |
Токсичность. Индустриальное загрязнение прибрежных вод кадмием приводит к накоплению металла в устрицах, крабах и других морских животных. Это приводит к отравлению кадмием и вызывает болезнь «итай-итай», получившую наиболее широкое распространение в Японии. Повреждение почек ведет к нарушениям метаболизма кальция и фосфора, что вызывает деформацию скелета, тяжелому повреждению нижних конечностей и болям в спине. Исследователи установили, что концентрация кадмия в пределах 100-140 мг/кг в мозговом веществе почек является критической для проявления токсичности кадмия.
Попадание кадмия в организм человека с парами и дымом вызывает признаки усталости, кашель, боль в груди, ощущение жжения в горле. Уровень кадмия в моче в этих случаях составляет 10-50 мкг/л.
Такая небольшая доза как 4 мг кадмия при попадании в организм человека через дыхательные пути является фатальной. Смертельная доза при пер оральном введении составляет несколько сотен миллиграмм в виде растворимой соли. При этом концентрация металла в печени составляла 128 мг/кг, в печени – 180 мг/кг.
Обнаружение кадмия в минерализате
Исследование минерализата на наличие ионов кадмия основано на экстракции его хлороформом в виде диэтилдитиокарбамината (ДДТК)2Сd при рН 12. полученное внутрикомплексное соединение разлагают хлороводородной кислотой и наличие ионов кадмия в водном растворе подтверждается химическими реакциями.
Выделение ионов кадмия из минерализата. Вначале из минерализата выделяют ионы кадмия, т.к. там помимо исследуемого соединения содержится ряд ионов, которые могут мешать ходу анализа. С этой целью к минерализату прибавляют диэтилдитиокарбамат натрия ДДТК-Na, который с ионами кадмия образует устойчивые внутрикомплексные соединения (ДДТК)2Сd:

С ДДТК-Na образуют комплексные соединения и другие, находящиеся в минерализате ионы(Fe3+, Cu2+, Zn2+). Их влияние устраняют введением сегнетовой соли (тартрат калия-натрия). Введение глицерина в реакционную смесь обеспечивает более полное выделение Сd2+, а прибавление гидроксида натрия – отделение Cd2+ от Zn2+ (образование сравнительно прочного цинката натрия.
Образовавшийся (ДДТК)2Сd экстрагируют хлороформом, а затем разлагают хлороводородной кислотой. В солянокислом растворе определяют наличие ионов кадмия следующими реакциями
С ДДТК-Na образуют комплексные соединения и другие, находящиеся в минерализате ионы(Fe3+, Cu2+, Zn2+). Их влияние устраняют введением сегнетовой соли (тартрат калия-натрия). Введение глицерина в реакционную смесь обеспечивает более полное выделение Сd2+, а прибавление гидроксида натрия – отделение Cd2+ от Zn2+ (образование сравнительно прочного цинката натрия.
Образовавшийся (ДДТК)2Сd экстрагируют хлороформом, а затем разлагают хлороводородной кислотой. В солянокислом растворе определяют наличие ионов кадмия следующими реакциями
Методы качественного обнаружения ионов кадмия:
1. Реакция с сульфидом натрия. К исследуемому солянокислому раствору добавляют по каплям 2.5н раствор гидроксида натрия до рН=5 (по универсальному индикатору) и свежеприготовленный 5% раствор сульфида натрия. При наличии ионов кадмия в растворе выпадает желтый осадок CdS.
Cd2++S2-→CdS↓
Предел обнаружения: 50 мкг ионов кадмия в пробе. Граница обнаружения: 2 мг ионов кадмия в 100 г биологического материала.
При отрицательном результате этой реакции дальнейшие исследования водной фазы на наличие ионов кадмия не производят. При положительной реакции дополнительно проверяют наличие ионов кадмия в водной фазе.
2. Реакция с гексацианоферратом (II) калия. Исследуемый раствор с помощью 2.5н раствора гидроксида натрия доводят до рН=5 (по универсальному индикатору) и к смеси добавляют 5% раствор гексацианоферрата (II) калия. При наличии ионов кадмия в растворе выпадает белый осадок.
3Cd2++2[Fe(CN)6]4-+2K+→K2Cd3[Fe(CN)6]2↓
Дополнительные реакции основаны на обнаружении ионов кадмия микрокристаллоскопическими реакциями:
1. Каплю исследуемого раствора наносят на предметное стекло и упаривают досуха, добавляют каплю насыщенного раствора бруцина в разбавленной серной кислоте, каплю 5% раствора бромида калия – в присутствии ионов кадмия образуется бесцветные призматические кристаллы в виде сфероидов.
2. На предметное стекло наносят каплю исследуемого раствора, упаривают досуха и на остаток наносят каплю 5% раствора бромида калия и каплю пиридина – выделяются бесцветные призматические кристаллы в виде сфероидов.
Микрокристаллоскопическими реакциями можно обнаружить 0,2 мг кадмия в 100 г биологического материала
Количественное определение.
1. Объемный метод. Комплексометрическое титрование ионов кадмия основано на выделении его из минерализата в виде (ДДТК)2Сd, реэкстракции с помощью раствора хлороводородной кислоты в водную фазу и комплексометрическом определении ионов кадмия при индикаторе эрихроме черном Т. Граница определения 1 мг.

