Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 184
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Фотоколориметрический метод.
Дитизоновый метод является наиболее подходящим для определения кадмия в биологическом материале.
Дитизонат кадмия, красного цвета, количественно экстрагируется четыреххлористым углеродом при рН 12. точность определения невелика, т.к. дитизонат кадмия не очень устойчив и поэтому превращает комплекс в свободный дитизон, взбалтывая раствор с хлороводордной кислотой. Оптическую плотность дитизона определяют при 620 нм.
При количественном определении ионов кадмия в присутствии обычно всех встречающихся вместе с ним элементов (цинк, кобальт, никель, свинец, висмут, серебро и медь) применяется следующий вариант дитизонового метода.
Сначала проводят экстракцию дитизоната кадмия из щелочного раствора, затем разрушают дитизонат кадмия, и переводят ионы кадмия в водный раствор обработкой хлороводородной кислотой и затем снова экстрагируют дитизонат кадмия из щелочной среды хлороформом. Оптическую плотность раствора определяют при 520 нм.
Следы ионов кадмия определяют методом атомной абсорбционной спектроскопии.
Следует обратить внимание на то, что при обнаружении и количественном определении ионов кадмия в объектах исследования обязательным является необходимость наличие и содержание данного металла в лабораторном стекле, реактивах и растворителях.
Выявление ионов стибиума
Сурьма (Sb).
Применение и токсичность соединений сурьмы.
Большинство соединений сурьмы токсичны. Соединения трёхвалентной сурьмы более токсичны, чем пятивалентной. Соединения сурьмы применяются в медицине и различных областях народного хозяйства. Они используются при изготовлении некоторых сортов стекла, красок, резиновых изделий. Сульфид сурьмы (V) применяют в пиротехнике, при производстве спичек, для вулканизации каучука и т.д. Металлическая сурьма входит в состав некоторых сплавов, которые используются при производстве подшипников, печатного шрифта и др. Хлорид сурьмы (III) используют для защиты металлов от коррозии.
В некоторых странах в медицине используют так называемый рвотный камень KOOC–CHOH–CHOH–COO–SbO как отхаркивающее и рвотное средство. В качестве химиотерапевтических препаратов применяются органические соединения сурьмы (натрий-антимонила тартрат, рвотный камень), солюсурмин (при лейшманиозе).
Клиническая картина отравления.
Парентеральное введение солей сурьмы вызывает кардиотоксичность; возможны коллапс и смерть вследствие анафилактического шока. Промышленное отравление обусловлено вдыханием соединений сурьмы в виде паров или порошка. Симптомы острого перорального отравления сурьмой напоминает наблюдаемые при остром отравлении мышьяком, и включают боли в животе, рвоту и диарею.
При патологоанатомическом исследовании трупов лиц, отравленных соединениями сурьмы, наблюдаются гиперемия ткани лёгких, кровоизлияние в лёгких и кишечном тракте. Сурьма выводится из организма в основном почками. Поэтому при отравлении сурьмой может развиться нефрит.
Исследование минерализатов на наличие сурьмы.
В минерализате сурьма находится в виде трёхвалентного состояния HSbO2 (метасурьмянистая кислота).
Для её определения сурьму трёхвалентную переводят в ацидокомплекс – H[SbCl6] с помощью нитрита натрия. Избыток нитрита натрия удаляют мочевиной:
HSbO2 + 2NaNO2 + 8HCl → H[SbCl6] + 2NO↑ + 2NaCl + 4H2O
2NaNO2 + 2HCl + O=C(NH2)2 → 2N2↑ + CO2↑ + 2NaCl + 3H2O
Гексахлоро (V) стибиат водорода с малахитовым или бриллиантовым зелёным образует ионный ассоциат, при прибавлении к которому толуола или ксилола слой органического растворителя окрашивается в голубой или синий цвет. Определению мешают Fe3+, Tl3+, Ag+.
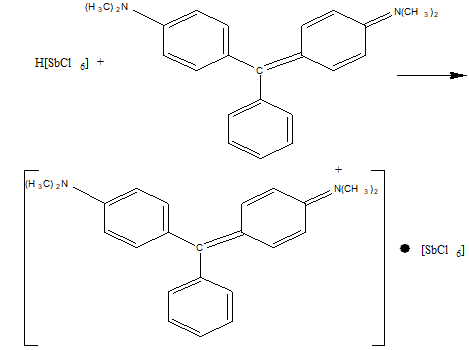
Эти реакции не специфичны и имеют предварительное значение.
Для подтверждения присутствия сурьмы в минерализате проводят следующие реакции.
1.Медная фольга в азотнокислой среде при наличии сурьмы окрашивается в пурпурно-чёрный цвет.
2.Реакция с тиосульфатом натрия в кислой среде – выпадает осадок оранжевого цвета – Sb2S3.
2Sb3+ + 3Na2S2O3 + 3H2O → Sb2S3 + 3Na2SO4 + 6H+
При несоблюдении условий реакции вместо Sb2S3 может образоваться красный осадок стибиевой киновари – Sb2ОS2
2Sb3+ + 2Na2S2O3 + 3H2O → Sb2OS3↓ + 2Na2SO4 + 6H+
При большом избытке кислоты вместо Sb2S3 выпадает осадок серы:
2Na2S2O3 + 3HCl → S↓ + SO2↓ + 2NaCl + H2O
Минерализат не рекомендуются разбавлять водой при наличии в нём хлорида сурьмы (III), т.к. при этом образуется белый осадок хлороксида сурьмы (III).
SbCl3 + H2O → SbOCl↓ + 2HCl
Количественное определение определение
Фотоколориметрические методы:
1.Содинения сурьмы (V) в солянокислой среде образуют с родамином В фиолетово-красное соединение RHSbCl6, экстрагируемое изопропиловым эфиром. Предварительно сурьму (III) переводят в сурьму (V).
2.Определение с метиловым фиолетовым или кристаллическим фиолетовым. Реакция аналогична предыдущей.
3.Определение с йодидом. Сурьма (III) в кислом растворе образует с йодид-ионами комплексные соединения жёлтого цвета. Ту же реакцию даёт и Sb (V). Образующееся соединение экстрагируется бензолом K[SbI4]
4.Фотоколориметрический метод на основе реакции соединений сурьмы (III) с малахитовым или бриллиантовым зелёным.
Выделение ионов висмута
Висмут
Среди элементов периодической системы висмут – последний практически не радиоактивный элемент. И он же открывает шеренгу тяжёлых металлов – естественных α-излучателей.
Традиционные потребители висмута – металлургическая (лёгкоплавкие сплавы), фармацевтическая (лекарственные средства) и химическая промышленность (красители, пигменты). Последние десятилетия к ним добавилась ядерная техника и электроника.
В медицинской практике применяются малорастворимые соединения висмута (алюминаты, карбонаты, галлаты, нитраты, салицилаты, цитраты в виде основных солей), как вяжущие антацидное средство при лечении язв диареи, сифилиса, дерматитов, эрозии, экземы, бородавок. К лекарственным средствам, содержащим висмут и включённых в номенклатуру разрешённых к применению в Украине препаратов относятся: нитрат висмута основной, ксероформ (триброфенолят висмута основной),дерматол (галлат висмута основной), бисмоверол (основная соль висмута и моновисмутовинной кислоты), пентеабисмол, хинина йодвисмутат.
Содержание в крови: концентрация висмута в крови пациентов, лечивших язву желудка и двенадцатипёрстной кишки, находилась в пределах от 0,001 до 0,012 мг/л.
Метаболизм и выделение. Малорастворимые соединения висмута принимаемые перорально в значительной степени выводятся с калом. Препараты висмута вводимые в организм в виде инъекции (обычно субсалицилаты, тиогликоляты, тригликоляты, йодвисмутаты, тартраты, цитраты) выводятся мочой в течение нескольких недель. Человеческий мозг, лёгкие и печень содержат менее чем 0,4 мг/кг. Содержание висмута в моче в норме составляет 0,018 мг/л. В то время как при лечении язвы препаратами, содержащими висмут, содержание его в моче составляет 0,480 мг/л.
При лечении сифилиса путём введения внутримышечно висмута салицилата (60-2100 мг в пересчёте на висмут) и умерших через 1-251 день, содержание элементов в ткани было следующим:
| Средняя концентрация висмута у больных подвергшихся лечению мг/л или мг/кг | ||||||
| кровь | мозг | легкон | печень | желчь | почка | Моча |
| 0,5 | 0,6 | 0,9 | 6,8 | 3,9 | 33 | 1,2 |
Токсичность. Проявление токсичности висмута подобны тем, которые наблюдаются при отравлении свинцом или ртутью. Усиленное слюноотделение, обесцвечивание языка, дёсен, кожи, боли в абдоминальной полости, тошнота. Повреждение почек является основным результатом приёма завышенной дозы висмута. Однако наблюдается явления энцефалопатии и периферической невропатии. Иногда наблюдается тошнота, рвота и нефротоксичность при внутримышечном введении висмута тиогликолята; причём функция почек возвращалась в норму через несколько недель. Подобная картина наблюдается и при пероральном приеме тригликолямата висмута. Постоянное употребление субгаллата висмута перорально, обычно назначаемого при желудочно-кишечных заболеваний, приводит к дрожанию мышц, нарушению координации движения, потери памяти, замешательство, раздражительность и временной потери зрения. В ряде случаев постоянное применение субсалицилата висмута приводит к энцефалопатии, концентрация висмута в крови при этом составляла 0,072 мг/л.
При отравлении висмутом, которое является результатом постоянного и длительного применения субнитрата висмута перорально концентрация его в крови была в пределах от 0,05 до 1,60 мг/л, а в моче – 0,15-10,25 мг/л. Все пациенты, которые выжили в первые 7-14 дней после появления признаков отравления, не зависимо от пути введения ви смута в организм, поправлялись без особого ущерба для здоровья.
Обнаружение висмута в минерализате.
Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и 8-оксихинолином (о-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтидитиокарбамата висмутом. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов.
Реакция с тиомочевиной. Во время взаимодействия ионов висмута с тиомочевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:
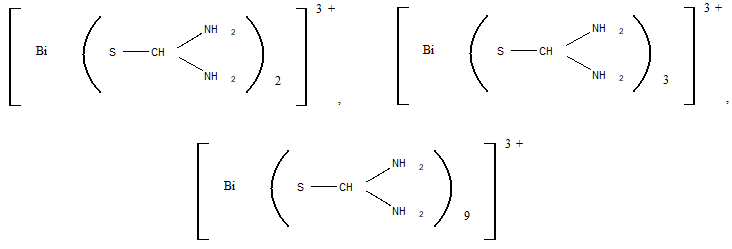
Образованию положительных комплексов мешают окислители.
Реакция с 8-оксихинолином (о-оксихинолином).
Эта реакция осонована на переведении ионов висмута в ацидокомплекс [BiI4]-, который при взаимодействии с 8-оксихинолином (о-оксихинолином) в кислой среде образует оранжево-краснный осадок. Этот осадок является ионным ассоциатом (иодвисмутат 8-оксихинолина). Образование этого ионного ассоциата можно изобразить следующими уравнениями
Bi3+ + 4KI → [BiI4]- + 4K+
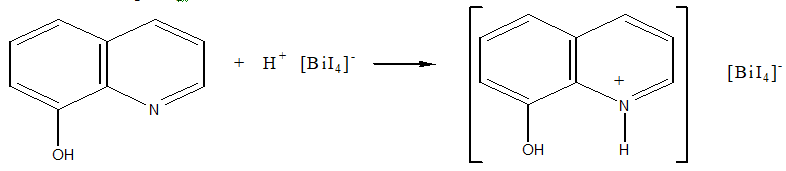
Этой реакции мешают окислители при наличии которых иодид-ионы переходят в иод, вследствие чего комплекс [BiI4]- образовываться не будет. Образованию иодвисмутата 8-оксихинолина мешают также катионы ряда металлов, которые с 8-оксихинолином образуют плохо растворимые соединения. С целью маскировки мешающих ионов к смеси добавляют аскорбиновую кислоту, восстанавливающую ионы железа (III), и сегнетовую соль, которая связывает другие ионы, мешающие обнаружению висмута.
Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения:0,1 мг в 100 г биологического материала.
Описанные реакции на висмут с тиомочевиной и 8-оксихинолином являются предварительными. Отрицательный результат реакции указывает на отсутствие ионов висмута в минерализате. При положительном результате этих реакций проводят дальнейшее исследование минерализата на наличие ионов висмута. С этой целью ионы висмута выделяют из минерализата в виде комплекса с диэтилдитиокарбаматом, который экстрагируют хлороформом, а затем разлагают кислотой.
Выделение ионов висмута из минерализата.
К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы висмута переходят в комплекс:
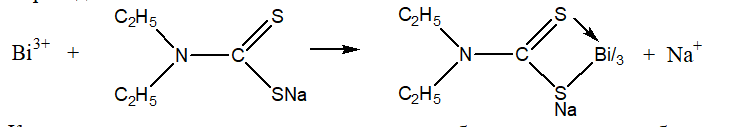

Кроме ионов висмута с диэтилдитиокарбаматом натрия образует комплексные соединения и другие ионы, содержащиеся в минерализате. Для маскировки этих ионов добавляют раствор трилона Б (комплексона (III)). образовавшийся комплекс диэтилдитиокарбамата висмута экстрагируют хлороформом, затем разлагают азотной кислотой. Висмут при этом переходит в водную фазу в виде Bi(NO3)3. Хлороформный слой отбрасывают.
При дальнейших исследованиях необходимо учитывать, что разбавление водой минерализата приводит к гидролизу нитрата висмута, который в виде белого аморфного соединения выпадает в осадок.

