Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 183
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, которые входят в состав тканей организма. Стадия деструкции заканчивается через 30—40 мин ипроходит при слабом нагревании. Деструктат представляет собой тяжелую прозрачную жидкость, которая имеет желтоватый или бурый цвет.
На второй стадии минерализации происходит полное разрушение органических веществ. Эта стадия более длительна (лимитируется временами разрушение жиров), проходит при большем нагревание (колбу Къельдаля помещают на асбестовую сетку) и с добавлением каплями азотной кислоты.
Минерализацию считают законченной, когда после прекращения добавления азотной кислоты при нагревании колбы начнут выделяться белые пары серной кислоты ине происходит почернения минерализата.
Денитрация
Денитрация — процесс освобождения минерализатов от азотной, азотистой, нитрозилсерной кислот и азота оксидов. Эти вещества являются окислителями, которые мешают последующему анализу на «металлические» яды.
Разработаны разнообразные методы денитрации.
Гидролизный метод (применяется на первых этапах) основан на разведение минерализатов водой с последующим нагреванием полученных жидкостей. При этом «летят» азотная и азотистая кислоты, азоту окислы, а нитрозилсерная кислота поддается гидролизу:
Метод длительный, требуется 15—17 час.
Для денитрации минерализатов были предложены восстановители (мочевина, натрию сульфит, формальдегид). Наилучшим реагентом является формальдегид, поскольку разрушение окислителей происходит быстро (1—2 хв), а избыток восстановителя легко удаляется кипячением в течение нескольких минут. Xимизм процессов, которые происходят, такой:

Для разрушения нитрозилсерной кислоты предварительно минерализат разводят водой и нагревают до 110°С, а затем добавляют формалин.
Проверку полноты денитрации делают по реакциии с дифениламином. При наличии окислителей появляется синяя окраска:
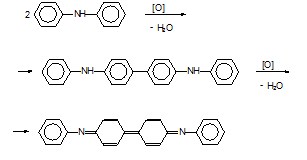
Необходим «слепой» опыт, потому что в серной кислоте (в которой растворяют дифениламин для опыта) может содержаться азотная кислота.
По внешнему виду минерализат в большинстве случаев являет собой бесцветную, прозрачную и достаточно тяжелую жидкость. Иногда минерализат бывает окрашенный в желтоватый — за счет катионов железа (ІІI), которое входит в состав тканей организма, зеленоватый — при наличии хрома (III) или голубоватый (за счет меди (II)) цвета. Достаточно часто минерализат содержит осадки: белый — за счет свинца, бария или кальция сульфатов, или грязно-зеленый — за счет соосадження хрома (III) сульфата.
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ ДРОБНОГО МЕТОДА АНАЛИЗА. ПРИЕМЫ «МАСКИРОВКИ» МЕШАЮЩИХ ИOHОB
В химико-токсикологическом анализе для обнаружения ионов металлов в минepaлизaтax применяются систематический ход анализа и дробный метод.
Систематический ход анализа (кислотный или сероводородный) основан на последовательном распределении катионов на аналитические группы, подгруппы и выделенные отдельных ионов из подгрупп. Систематический метод длителен, опасен, связан с большими потерями ядов, потому его практически вытеснил из практики химико-токсикологического анализа дробный метод.
Дробный метод основывается на использовании реакций, с помощью которых в любой последовательности можно обнаружить ионы металлов в отдельных небольших порциях исследуемого раствора. Дробний метод быстрый, чувствительный, позволяет определить «металлические» яды без предыдущего отделения их одна от другой. Основателем дробного метода анализа является М. А. Тананаев, большая заслуга в разработке методик дробного метода и внедрения их в практику химико-токсикологического анализа принадлежит О. М. Криловой. В основе дробного метода лежат такие приемы:
— замена осаждения жидкофазними реакциями комплексообразования с последующими экстракцией и реэкстракцией; использование наиболее чувствительных и специфических реакций (например, на марганец — окисления до перманганат-иoнов, на хром — образование надхромовых кислот и тому подобное);
— при недостаточной специфичности реакций сначала проводят предварительную пробу, потом — подтверждающие исследование;
— «маскировка» ионов, которые мешают анализу, при этом устраняют влияние ионов как естественных, так и введенных к организму.
Способы «маскировки» мешающих ионов
1. Комплексообразование. В такой cпocоб мешающие ионы связывают в бесцветные стойки комплексы. Для маскировки используют цианиды, фториды, фосфаты, тиосульфат, тиомочевину, трилон Б, аскорбиновую кислоту, гидроксиламин.
Например, реакции на Со2+ с роданидом мешают Fe3+, потому добавляют растворы фторидов или фосфатов, которые связывают Fe3+ в бесцветные комплексы [FeF6]3- или [Fe(PО4)2]3-.
2. Оперирование малыми объемами или большими разведеннями минерализата для устранения влияния эндогенных ионов металлов; с этой целью минерализат сразу разводят до 180 мл и используют небольшие порции для выявления отдельных ионов: для Мn2+ — 1; Сu2+ - 3; Bi+ - 10 мл и так далее
3. Вариирование рН среды. Таким путем комплексы дитизоном свинца образуются только в щелочной среде, в кислой среде комплексы из дитизоном образуют ртуть и серебро, при сильном подкислении серебра дитизонат разрушается, а ртуть дитизонат — нет.
4. Применение реакции окисления. Перманганат-иoн переводят в ион марганца (II) при выявлении хрома по реакции с дифенилкарбазидом.
5. Использование ряда активности диэтилдитиокарбаминатив (ДДТК) — свинец из ДДТК вытесняется медью, медь — ртутью
СХЕМА АНАЛИЗА МИНЕРАЛИЗАТА НА «МЕТАЛЛИЧЕСКИЕ» ЯДЫ ПО О. М. КРИЛОВОЙ. ОБНАРУЖЕНИ РТУТИ В ДЕСТРУКТАТИ
1. Отделение осадков PbSО4 и BaSО4от основного объема минерализата — фильтрат I.
2. Промывание осадка водой, подкисленной серной кислотой, - для удаления соосадженных ионов Fe3+; Cu2+; Zn2+; Cd2+ и др. Если осадок имеет грязно-зеленый цвет, его промывают аммония персульфатом (для отмывания от Сг3+). Для разделения бaрия и свинца сульфатов осадок обрабатывают горячим раствором аммонию ацетата, PbSО4 растворяется — фильтрат II:
2PbSO4 + 2CH3COONH4 = [Pb(CH3COO)2·PbSO4] + (NH4)2 SO4
Исследование осадка бария сульфата. Перекристаллизации бария сульфата c концентрированной серной кислота. Реакция чувствительна, при негативном результате исследования на барий можно закончить.
Реакция получения осадка бария йодату:
BaSO4 + 2C = BaS + 2CO2
окрашивание пламени горелки в зеленый цвет,
BaS + 2HCl = BaCl2 + H2S
Ba2+ + 2IO3- Ba(IO3)2
характерные бесцветные кристаллы.
Реакция высокочувствительна, обнаружению бария не мешают другие элементы.
Исследование фильтрата IІ на Рb2+. Реакция с хлороформным раствором дитизона в щелочной среде (рН = 7,5—8,0); наблюдают красную расцветку хлороформного слоя.
Реакция предварительная: при негативном результате исследования заканчивают, при позитивном — проводят подтверждающие реакции.
После реэкстракции Рb2+ в водную фазу проводят реакции образования осадков PbS; PbSO4;PbCrO4; РbI2, наблюдая при этом соответственно черный, белый, оранжево-желтый и желтый осадки; даны реакции подтверждающие.
Проводят так же реакцию с родизонатом натрия:
Схема дробного анализа минерализата на «металлические яды»: марганец, хром, серебро, медь и цинк.
Исследование фильтрата I
Выявление марганца Мn2+. Используют две специфических реакции окисления Мn2+ c помощью калия перйодата и аммония персульфата до перманганат-иoнов, которые имеют фиолетовую окраску. В реакции с калия перйодатом для маскировки ионов, которые мешают реакции (ионы Fe3+), используют натрия дигидрофосфат:
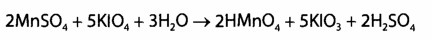

Реакция высокочувствительна (обнаруживает эндогенный марганец), имеет самостоятельное значение при отрицательном результате, при положительном — выполняют подтверждающую реакцию:
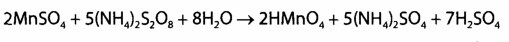

Реакция проходит при наличии катализатора — серебра нитрата, для маскировки Fe3+ используют дигидрофосфаты.
Обнаружение Сг
Выявление Сг3+. Реакция с дифенилкарбазидом высокочувствительна, но не специфическая. Для маскировки ионов, которые мешают (железо, сурьма), добавляют фосфат ионы перманганата возобновляют с помощью натрия азида.
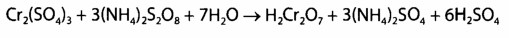
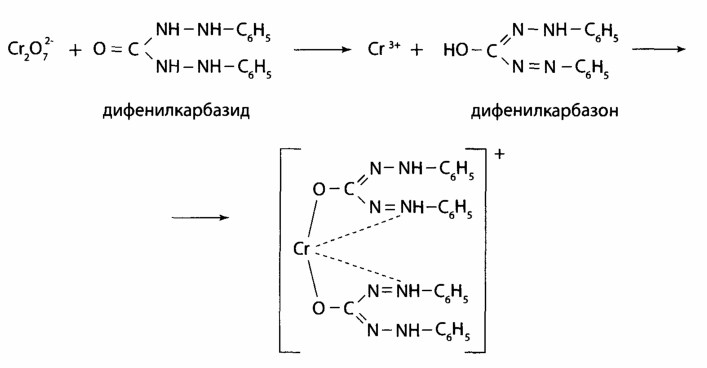
Реакции окисления Сг
3+ до надхромовых кислот, которые имеют синюю окраску и более стойкие в органических растворителях, чем в воде:
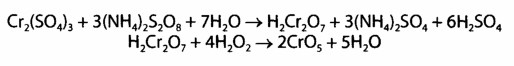
Данная реакция специфическая для хрома.
Выявление Сu
Выявление Сu2+. Реакция из (ДДТК)2РЬ — специфический реактив на Сu2+ (в соответствии с правилом рядов Тананаева свинец витесняют из комплекса, кроме меди, только серебро и ртуть). Наблюдается желто-коричневая окрашивание хлороформного слоя.
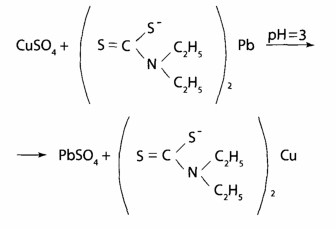

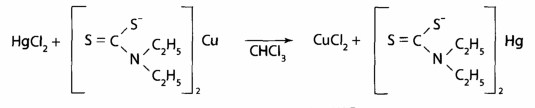
При положительном результате реакции реэкстрагируют медь в водный слой с помощью HgCl2 и проводят подтверждающие исследование.

Реакция с пиридин-родановым реактивом:
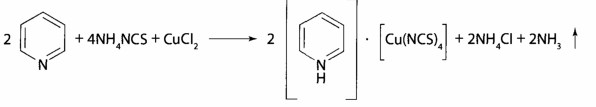

образуется изумрудно-зеленый осадок, который растворяется в хлороформе.
Реакция с калию гексацианофератом (II):
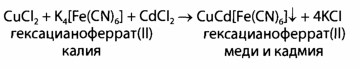

Выявление Ag+
Выявление Ag+. Образование серебра дитизоната в сернокислой среде, наблюдают золотисто-желтую окраску хлороформного слоя. Для того, чтобы отличить от ртути дитизоната, окрашенного в оранжево-желтый цвет, серебра дитизонат разрушают 0,5 н раствором соляной кислоты; ртути дитизонат в этих условиях не изменяется.
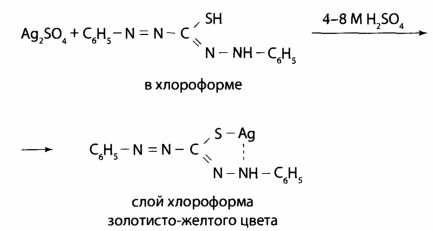

При позитивном результате этой реакции серебро осаждают из всего объема минерализата в виде AgCl. Осадок фильтруют и проводят подтверждающие исследование. Для этого его обрабатывают раствором аммиака:
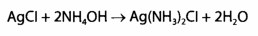
На второй стадии минерализации происходит полное разрушение органических веществ. Эта стадия более длительна (лимитируется временами разрушение жиров), проходит при большем нагревание (колбу Къельдаля помещают на асбестовую сетку) и с добавлением каплями азотной кислоты.
Минерализацию считают законченной, когда после прекращения добавления азотной кислоты при нагревании колбы начнут выделяться белые пары серной кислоты ине происходит почернения минерализата.
Денитрация
Денитрация — процесс освобождения минерализатов от азотной, азотистой, нитрозилсерной кислот и азота оксидов. Эти вещества являются окислителями, которые мешают последующему анализу на «металлические» яды.
Разработаны разнообразные методы денитрации.
Гидролизный метод (применяется на первых этапах) основан на разведение минерализатов водой с последующим нагреванием полученных жидкостей. При этом «летят» азотная и азотистая кислоты, азоту окислы, а нитрозилсерная кислота поддается гидролизу:
Метод длительный, требуется 15—17 час.
Для денитрации минерализатов были предложены восстановители (мочевина, натрию сульфит, формальдегид). Наилучшим реагентом является формальдегид, поскольку разрушение окислителей происходит быстро (1—2 хв), а избыток восстановителя легко удаляется кипячением в течение нескольких минут. Xимизм процессов, которые происходят, такой:

Для разрушения нитрозилсерной кислоты предварительно минерализат разводят водой и нагревают до 110°С, а затем добавляют формалин.
Проверку полноты денитрации делают по реакциии с дифениламином. При наличии окислителей появляется синяя окраска:

Необходим «слепой» опыт, потому что в серной кислоте (в которой растворяют дифениламин для опыта) может содержаться азотная кислота.
По внешнему виду минерализат в большинстве случаев являет собой бесцветную, прозрачную и достаточно тяжелую жидкость. Иногда минерализат бывает окрашенный в желтоватый — за счет катионов железа (ІІI), которое входит в состав тканей организма, зеленоватый — при наличии хрома (III) или голубоватый (за счет меди (II)) цвета. Достаточно часто минерализат содержит осадки: белый — за счет свинца, бария или кальция сульфатов, или грязно-зеленый — за счет соосадження хрома (III) сульфата.
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ ДРОБНОГО МЕТОДА АНАЛИЗА. ПРИЕМЫ «МАСКИРОВКИ» МЕШАЮЩИХ ИOHОB
В химико-токсикологическом анализе для обнаружения ионов металлов в минepaлизaтax применяются систематический ход анализа и дробный метод.
Систематический ход анализа (кислотный или сероводородный) основан на последовательном распределении катионов на аналитические группы, подгруппы и выделенные отдельных ионов из подгрупп. Систематический метод длителен, опасен, связан с большими потерями ядов, потому его практически вытеснил из практики химико-токсикологического анализа дробный метод.
Дробный метод основывается на использовании реакций, с помощью которых в любой последовательности можно обнаружить ионы металлов в отдельных небольших порциях исследуемого раствора. Дробний метод быстрый, чувствительный, позволяет определить «металлические» яды без предыдущего отделения их одна от другой. Основателем дробного метода анализа является М. А. Тананаев, большая заслуга в разработке методик дробного метода и внедрения их в практику химико-токсикологического анализа принадлежит О. М. Криловой. В основе дробного метода лежат такие приемы:
— замена осаждения жидкофазними реакциями комплексообразования с последующими экстракцией и реэкстракцией; использование наиболее чувствительных и специфических реакций (например, на марганец — окисления до перманганат-иoнов, на хром — образование надхромовых кислот и тому подобное);
— при недостаточной специфичности реакций сначала проводят предварительную пробу, потом — подтверждающие исследование;
— «маскировка» ионов, которые мешают анализу, при этом устраняют влияние ионов как естественных, так и введенных к организму.
Способы «маскировки» мешающих ионов
1. Комплексообразование. В такой cпocоб мешающие ионы связывают в бесцветные стойки комплексы. Для маскировки используют цианиды, фториды, фосфаты, тиосульфат, тиомочевину, трилон Б, аскорбиновую кислоту, гидроксиламин.
Например, реакции на Со2+ с роданидом мешают Fe3+, потому добавляют растворы фторидов или фосфатов, которые связывают Fe3+ в бесцветные комплексы [FeF6]3- или [Fe(PО4)2]3-.
2. Оперирование малыми объемами или большими разведеннями минерализата для устранения влияния эндогенных ионов металлов; с этой целью минерализат сразу разводят до 180 мл и используют небольшие порции для выявления отдельных ионов: для Мn2+ — 1; Сu2+ - 3; Bi+ - 10 мл и так далее
3. Вариирование рН среды. Таким путем комплексы дитизоном свинца образуются только в щелочной среде, в кислой среде комплексы из дитизоном образуют ртуть и серебро, при сильном подкислении серебра дитизонат разрушается, а ртуть дитизонат — нет.
4. Применение реакции окисления. Перманганат-иoн переводят в ион марганца (II) при выявлении хрома по реакции с дифенилкарбазидом.
5. Использование ряда активности диэтилдитиокарбаминатив (ДДТК) — свинец из ДДТК вытесняется медью, медь — ртутью
СХЕМА АНАЛИЗА МИНЕРАЛИЗАТА НА «МЕТАЛЛИЧЕСКИЕ» ЯДЫ ПО О. М. КРИЛОВОЙ. ОБНАРУЖЕНИ РТУТИ В ДЕСТРУКТАТИ
1. Отделение осадков PbSО4 и BaSО4от основного объема минерализата — фильтрат I.
2. Промывание осадка водой, подкисленной серной кислотой, - для удаления соосадженных ионов Fe3+; Cu2+; Zn2+; Cd2+ и др. Если осадок имеет грязно-зеленый цвет, его промывают аммония персульфатом (для отмывания от Сг3+). Для разделения бaрия и свинца сульфатов осадок обрабатывают горячим раствором аммонию ацетата, PbSО4 растворяется — фильтрат II:
2PbSO4 + 2CH3COONH4 = [Pb(CH3COO)2·PbSO4] + (NH4)2 SO4
Исследование осадка бария сульфата. Перекристаллизации бария сульфата c концентрированной серной кислота. Реакция чувствительна, при негативном результате исследования на барий можно закончить.
Реакция получения осадка бария йодату:
BaSO4 + 2C = BaS + 2CO2
окрашивание пламени горелки в зеленый цвет,
BaS + 2HCl = BaCl2 + H2S
Ba2+ + 2IO3- Ba(IO3)2
характерные бесцветные кристаллы.
Реакция высокочувствительна, обнаружению бария не мешают другие элементы.
Исследование фильтрата IІ на Рb2+. Реакция с хлороформным раствором дитизона в щелочной среде (рН = 7,5—8,0); наблюдают красную расцветку хлороформного слоя.
Реакция предварительная: при негативном результате исследования заканчивают, при позитивном — проводят подтверждающие реакции.
После реэкстракции Рb2+ в водную фазу проводят реакции образования осадков PbS; PbSO4;PbCrO4; РbI2, наблюдая при этом соответственно черный, белый, оранжево-желтый и желтый осадки; даны реакции подтверждающие.
Проводят так же реакцию с родизонатом натрия:
Схема дробного анализа минерализата на «металлические яды»: марганец, хром, серебро, медь и цинк.
Исследование фильтрата I
Выявление марганца Мn2+. Используют две специфических реакции окисления Мn2+ c помощью калия перйодата и аммония персульфата до перманганат-иoнов, которые имеют фиолетовую окраску. В реакции с калия перйодатом для маскировки ионов, которые мешают реакции (ионы Fe3+), используют натрия дигидрофосфат:

Реакция высокочувствительна (обнаруживает эндогенный марганец), имеет самостоятельное значение при отрицательном результате, при положительном — выполняют подтверждающую реакцию:

Реакция проходит при наличии катализатора — серебра нитрата, для маскировки Fe3+ используют дигидрофосфаты.
Обнаружение Сг
Выявление Сг3+. Реакция с дифенилкарбазидом высокочувствительна, но не специфическая. Для маскировки ионов, которые мешают (железо, сурьма), добавляют фосфат ионы перманганата возобновляют с помощью натрия азида.

Реакции окисления Сг
3+ до надхромовых кислот, которые имеют синюю окраску и более стойкие в органических растворителях, чем в воде:
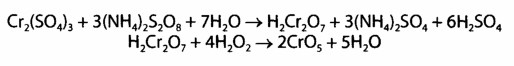
Данная реакция специфическая для хрома.
Выявление Сu
Выявление Сu2+. Реакция из (ДДТК)2РЬ — специфический реактив на Сu2+ (в соответствии с правилом рядов Тананаева свинец витесняют из комплекса, кроме меди, только серебро и ртуть). Наблюдается желто-коричневая окрашивание хлороформного слоя.


При положительном результате реакции реэкстрагируют медь в водный слой с помощью HgCl2 и проводят подтверждающие исследование.


Реакция с пиридин-родановым реактивом:


образуется изумрудно-зеленый осадок, который растворяется в хлороформе.
Реакция с калию гексацианофератом (II):


Выявление Ag+
Выявление Ag+. Образование серебра дитизоната в сернокислой среде, наблюдают золотисто-желтую окраску хлороформного слоя. Для того, чтобы отличить от ртути дитизоната, окрашенного в оранжево-желтый цвет, серебра дитизонат разрушают 0,5 н раствором соляной кислоты; ртути дитизонат в этих условиях не изменяется.


При позитивном результате этой реакции серебро осаждают из всего объема минерализата в виде AgCl. Осадок фильтруют и проводят подтверждающие исследование. Для этого его обрабатывают раствором аммиака:

