ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 25
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Триптофан относится к группе ароматических аминокислот и для человека является незаменимой аминокислотой. Поступающий в составе белков пищи триптофан в основном используется для биосинтеза белков, биогенного амина серотонина и гормона мелатонина, и ниацина (витамин PP).
Метаболизм триптофана: 2 пути -1) Кинурениновый (основной) – окисление триптофана с образованием кинурениновой кислоты. Большая часть кинурениновой кислоты расподается до ацетил – SkoA, но некоторая часть идет на синтез никотиновой кислоты. 2) Серотониновый – окисление до окситриптофана с образованием серотонина и мелатонина (не путать: меланин (пигмент), мелатонин – гормон, отвечающий за регуляцию биологических часов)
С
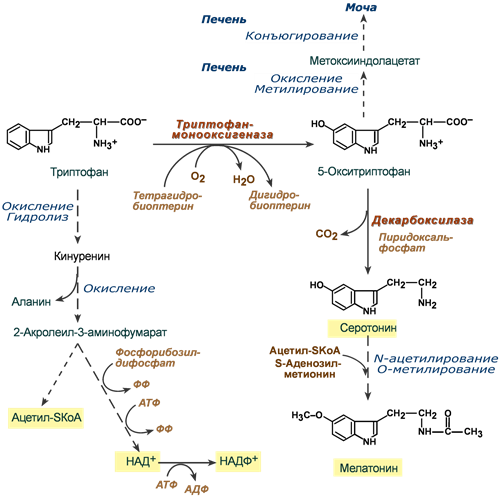 индром Хартнупа – возникает в результате дефекта транспортного белка для нейтральный аминокислот. Что приводит к снижению распада триптофана в кишечнике и реабсорбции в почках. В кишечнике триптофан подвергается воздействию микрофлоры с образованием производных (индолы, кинуренин и серотонин), которые всасываются и обнаруживаются в моче. В крови снижается концентрация триптофана, возрастает потеря нейтральных аминокислот с мочой, развивается гипераминоацидурии. Так как триптофан необходим для синтеза эндогенного витамина РР, то клиническая картина характеризуется признаками пеллагры – недостаточности витамина B3 (PP, ниацина). Одним из ярких проявлений синдрома является симптом голубых пеленок, возникающий из-за того, что избыток триптофана в кишечнике под действием микрофлоры превращается в индол, который всасывается в кровь и в печени обезвреживается до индикана. Далее индикан выводится с мочой и на воздухе окисляется в индиго. Кнаппа-Компровера: Связан с дефектом фермента кинурениазы. Неадекватные величины кинуренина в крови позволяют ему преодолевать гематоэнцефалический барьер, токсически воздействуя на клетки нейроглии, провоцируя психоневрологические расстройства
индром Хартнупа – возникает в результате дефекта транспортного белка для нейтральный аминокислот. Что приводит к снижению распада триптофана в кишечнике и реабсорбции в почках. В кишечнике триптофан подвергается воздействию микрофлоры с образованием производных (индолы, кинуренин и серотонин), которые всасываются и обнаруживаются в моче. В крови снижается концентрация триптофана, возрастает потеря нейтральных аминокислот с мочой, развивается гипераминоацидурии. Так как триптофан необходим для синтеза эндогенного витамина РР, то клиническая картина характеризуется признаками пеллагры – недостаточности витамина B3 (PP, ниацина). Одним из ярких проявлений синдрома является симптом голубых пеленок, возникающий из-за того, что избыток триптофана в кишечнике под действием микрофлоры превращается в индол, который всасывается в кровь и в печени обезвреживается до индикана. Далее индикан выводится с мочой и на воздухе окисляется в индиго. Кнаппа-Компровера: Связан с дефектом фермента кинурениазы. Неадекватные величины кинуренина в крови позволяют ему преодолевать гематоэнцефалический барьер, токсически воздействуя на клетки нейроглии, провоцируя психоневрологические расстройства-
Структурные компоненты нуклеотидов, типы связей. Моно-, ди-, полинуклеотиды на примере коферментов, макроэргов, вторичных посредников, их роль.
Нуклеотиды состоят из азотистого основания, моносахарида – рибоза или пентоза, и остатка фосфорной кислоты. Нуклеозиды – это соединения азотистого основания и моносахарида. Моносахарид соединятся с азотистым основанием посредствой N-гликозидной связи, образованная меду углеродом и азотом. Остаток фосфорной кислоты присоединен фосфоэфирной связью между 3 и 5 атомом углерода с образование 3, 5 фосфодиэфирной связи. 1) ц-АМФ (мононуклеотид) – служащий second messenger (вторичным посредником) – переводящим сигнал гормона внутрь клетки. Динуклеотиды обычно выполняют роль коферментов. Большая часть входит в состав дегидрогеназ (НАД+, НАД+Ф, ФАД). Еще один, единственный их представитель – НS-KoA – облигатный участник реакций ацилирования. Также мононуклеотиды играют роль макроэргов – АТФ, АДФ, ГТФ и др. Также мононуклеотиды являются переносчиками мономеров (УДФ – глюкоза, ЦДФ – холин)
-
Виды РНК (информационная, рибосомальная, транспортная) и ДНК (ядерная, митохондриальная), особенности строения, роль.
В отличии от ДНК у РНК азотистое основание вместо тимина – урацил. Молекулы РНК намного меньше чем у ДНК. Известны 2 типа РНК: 1) Двухцепочечная – заменитель ДНК у вирусов – служит местом хранения генетической информации. 2) Одноцепочечная – хар-ная для большинства организмов. Особенность иРНК – 1-2% от всех РНК в организме. В своем строении имеет 1) КЭП – особая структура на 5 конце иРНК, представленная 7 метилгуанозинтрифосфатом. Функция -1) предотвращение от расщепления нуклеазами 2) Используется для узнавания иРНК в процессе трансляции. тРНК – 15% от общейго числа рнк, состоит примерно из 80 нуклеотидов. Все тРНК имеют сложную структуру в виде клеверного листа. На клеверном листе разлечают 4 участка – 3 конец акцепторная ветвь – присоединение АК 2) Напротив- антикодоновая ветвь – участок, который содержит 3 нуклеотида со свободными связями, которые комплементарны кодону иРНК. 3) T – ветвь – участок, которым присоединятся к рибосоме 4) Д – ветвь – участок, обеспечивающий взаимодействие с тРНК синтетазой. рРНК – 80-90% - самые большие размеры – 3000-5000 нуклеотидов. Представляет собой структурный компонент рибосом. Малая субъединица состоит из 1 рРНК и 33 белков, большая – из 3 рРНК и 50 белков. Функции: 1) Структурный компонент рибосом 2) Обеспечивают правильность связывания рибосомы с мРНК 3) Правильность связывания рибосомы с тРНК. Отличия ядерной ДНК от митохондриальной: 1) Ядерная внутри ядра, митохондриальная в митохондриях 2) Ядерная ДНК линейная, тогда как митохондриальная кольцевая ДНК. 3) Молекулярная масса ядерной ДНК во много раз больше митохондриальной 4) Ядерная ДНК – 46 хромосом, митохондриальная – 1 хромосома. Роль: обе кодируют информацию о строении белков, но ядерная хранит строение о всех белках, в то время как митохондриальная только о метаболически активных белках (ферментах). Клиническая роль: митохондриальная ДНК передается по наследству только от матери.
-
Пищевые источники нуклеопротеинов. Переваривание в ЖКТ. Конечные продукты гидролиза нуклеопротеинов и их всасывание.
Н
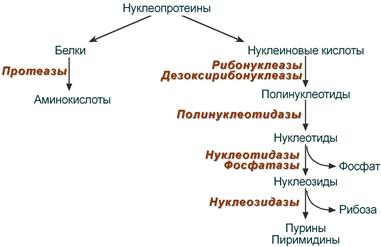 уклеотиды поступают в организм с пищей, главным образом в составе нуклеопротеинов. После воздействия соляной кислоты и протеолитических ферментов желудка нуклеопротеины распадаются до нуклеиновых кислот и белковой части. Белки перевариваются обычным образом, нуклеиновые кислоты – с помощью дополнительных ферментов. (В желудке под действием HCl – нуклепротеины могут распадаться до нуклеиновых кислот и белков) Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы, гидролизующие все нуклеиновые кислоты до полинуклеотидов. После действия панкреатических ферментов полинуклеотидазы (фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований. В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой. Большая часть тех пуринов, что всосались, в энтероцитах также окисляется в мочевую кислоту, при этом не происходит их перехода в кровь, в другие клетки и включения во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот. Свободные пиримидиновые основания, подобно пуринам, в основном катаболизируют и выделяются без их использования в организме.
уклеотиды поступают в организм с пищей, главным образом в составе нуклеопротеинов. После воздействия соляной кислоты и протеолитических ферментов желудка нуклеопротеины распадаются до нуклеиновых кислот и белковой части. Белки перевариваются обычным образом, нуклеиновые кислоты – с помощью дополнительных ферментов. (В желудке под действием HCl – нуклепротеины могут распадаться до нуклеиновых кислот и белков) Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы, гидролизующие все нуклеиновые кислоты до полинуклеотидов. После действия панкреатических ферментов полинуклеотидазы (фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований. В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой. Большая часть тех пуринов, что всосались, в энтероцитах также окисляется в мочевую кислоту, при этом не происходит их перехода в кровь, в другие клетки и включения во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот. Свободные пиримидиновые основания, подобно пуринам, в основном катаболизируют и выделяются без их использования в организме. -
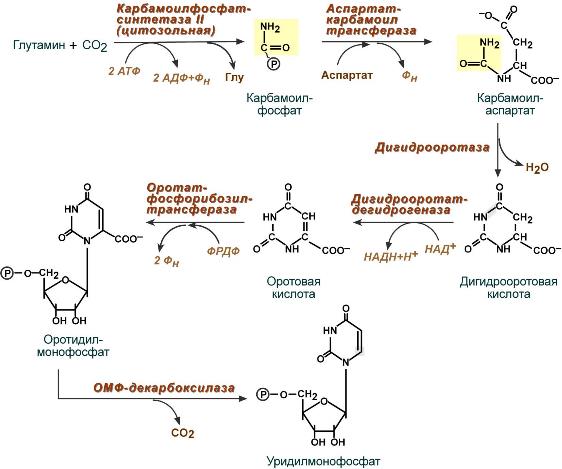
Пиримидиновые нуклеотиды. Особенности катаболизма и анаболизма. Нарушения обмена на примере оротацидурии.
Синтез пиримидиновых оснований происходит во всех клетках организма. К пиримидинам относят цитозин, урацил, и тимин.
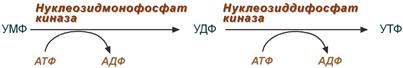

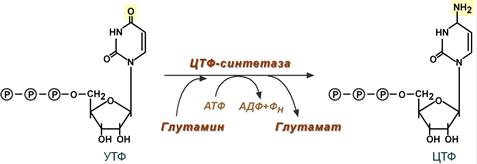
Далее УТФ под действием ЦТФ синтетазы превращается в ЦТФ
Оротацидурии – патологическое состояние характеризующиеся нарушением работы ферментов: Оротат фосфорибозил ТФ и ОМФ – декарбоксилазы (или УМФ синтазы). Заболевание проявляется в раннем возрасте, характеризующиеся мегалобластической анемией – пат. состояние хар-ся снижением скорости деления клеток эритроцитарного ряда. появляется сонливость, вялость, отставание умственного и физического развития. Диагноз ставится при обнаружении в охлажденной моче оранжевых игольчатых кристаллов оротовой кислоты.
Стоит отметить, что в отличие от разветвленного синтеза пуринов этот синтез происходит линейно, т.е. пиримидиновые нуклеотиды образуются последовательно, друг за другом.
Р
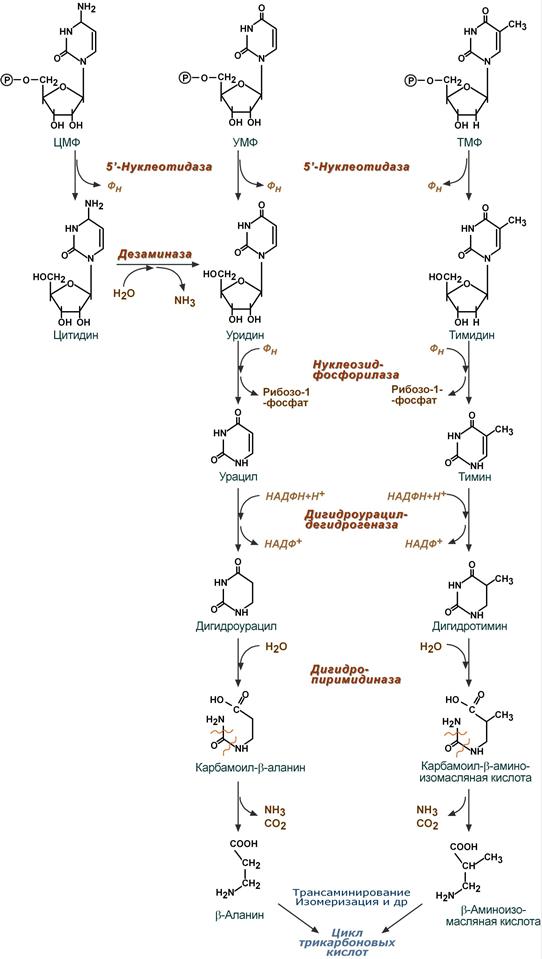 аспад пиримидинов
аспад пиримидиновОсобнность катаболизма: В отличии от пуринов, продукты распада пиримидинов хорошо растворяются в воде, и вступают в реакции трансаминирования и изомеризации – превращаясь в оксалоацетат и пируват. Либо выводятся с мочой.
-
Пуриновые нуклеотиды. Особенности синтеза и его субстраты. «Запасные пути» синтеза пуриновых нуклеотидов. Последствия генетического дефекта гипоксантингуанинфосфо-рибозилтрансферазы. Синдром Леша–Найхана.
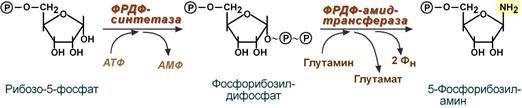
Первая реакция синтеза пуринов заключается в активации углерода в положении С1 рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ). Фосфорибозил-дифосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл. Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 с образованием 5'-фосфорибозиламина.
Далее идет синтез инозинмонофосфата – 9 реакций, (в которые включается такие компоненты: глицин, аспартат, глутамин, со2, произдвоные ТГФК, 6 молекул АТФ.) в результате которых образуется инозинмонофосфорная кислота. Дальше идет синтез АМФ И ГМФ.
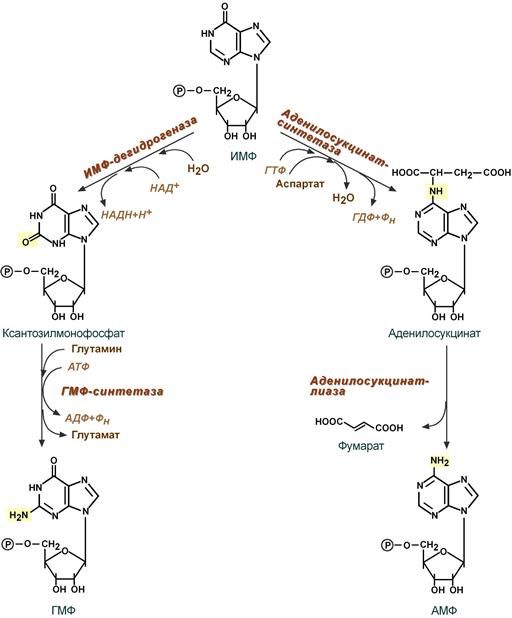
Образование нуклеозидтрифосфатов АТФ И ГТФ
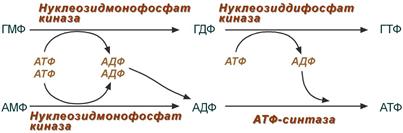
Запасные пути (или реутилизация) синтеза пуринов заключается в переработке азотистых оснований: Гуанина и аденина, и гипокстантина посредством присоединения к ним фосфорибозилдифосфата под действием ферментов аденозин-фосфорибозил-ТФ и гуанин (гипоксантин) фосфорибозил ТФ с образованием нуклеозидов: АМФ, ИМФ, ГМФ. Активация «запасных путей» происходит в быстрорастущих тканях (эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот.
Болезнь Леша-Нихана – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы, фермента, отвечающего за реутилизацию пуриновых оснований. Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание физического развития (с трудом держит голову), повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. Наиболее характерный признак заболевания – это самокалечение - неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах.
-
Катаболизм пуриновых нуклеотидов. Гиперурикемия и подагра.

Реакции распада пуринов можно условно разделить на 5 стадий:
1. Дефосфорилирование АМФ и ГМФ – фермент 5'-нуклеотидаза. 2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин. 3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза. 4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза. 5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза (описание фермента см здесь). Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO


