ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 27
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Процессинг транскриптонов: Это структурное и химическое изменение вновь синтезируемой молекулы РНК. Промежуточный этап между транскрипцией и трансляцией. Процессинг происходит в три этапа: 1) Кэпирование 5 конца – модификация с образованием метилированного гуанина, способствует защите от эндонуклеаз, необходим для транспорта и связывания мРНК с рибосомой. 2) Полиаденилирование 3 конца – модификация с присоединением к растущей цепи РНК 100-200 остаток адениловой кислоты. В результате формируется ПолиА (полиадениловая) последовательность, которая замедляет гидролиз РНК в цитоплазме (Этот хвост определяет время жизни). 3)Сплайсинг – вырезание интронов и сшивание экзонов.
Трансляция – процесс синтеза полипептида по матрице иРНК с участием свободных аминокислот (которые плавают в цитоплазме) в рибосоме. Как и во всех матричных синтезах выделяют 3 этапа: Инициация, элонгация, терминация. Строение центра рибосом: P-центр – пептидальный: Место начала синтеза белка, при инициации здесь находится тРНК с МЕТ, при элонгации тРНК с другими аминокислотами. A-центр – аминоацильный – также находятся тРНК с аминокислотами (на этапе элонгации именно суда будут приходить тРНК с аминокислотами). Стадии синтеза. Инициация: 1) мРНК связывается с малой субъединицей рибосомы, кодон AUG (кодирующий метионин) устанавливается в P -центре. 2)Инициирующая тРНК (несущая метионин) по принципу комплементарности связывается антикодоном с кодоном AUG. 3) Большая субъединица соединяется с малой. Элонгация: циклический процесс, который повторяет первый цикл. Первый цикл элонгации включает 3 шага: 1) Присоединение тРНК с а/к к аминоацильному участку (Антикодон тРНК комплементарен кодону мРНК). 2) Фермент пептидилТФ осуществляет перенос а/к c пептидального участка на аминоацильный к 2 аминокислоте – происходит образование пептидной связи. 3) Фермент транслоказа перемещает мРНК относительно рибосомы так,что первый кодон АУГ оказывается вне рибосомы, второй кодон становится напротив P центра, а напротив А центра оказывается третий кодон. Для всех этих процессов необходима энергия ГТФ.
Т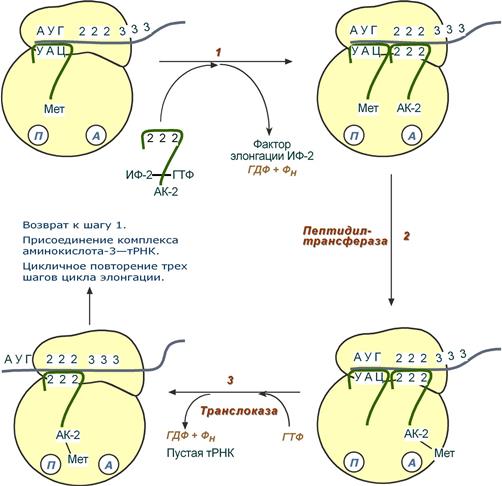 ерминация: Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют: 1)Гидролитическое отщепление полипептида от конечной тРНК 2) Отщепление от P центра уже пустой тРНК 3) Диссоциацию рибосомы.
ерминация: Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют: 1)Гидролитическое отщепление полипептида от конечной тРНК 2) Отщепление от P центра уже пустой тРНК 3) Диссоциацию рибосомы.
Посттрансляционная модификация белков. После процесса синтеза белков, происходит модификация определенных аминокислотных остатков. Функциональное значение: 1) Обеспечение правильной сборки белков 2) Регуляция активности белков 3) Передача сигнала. Примеры: Образование γ-карбоксиглутаминовой кислоты в белках, образующих комплексы с ионами Cа 2+ : протромбин, остеокальцин. Иодирование остатков Tyr в тиреоглобулине, идущем на синтез тиреоидных гормонов. Отщепление инициирующего Met (эукариоты). Гликолизирование белков (Защита от протеаз, становятся клеточными рецепторами – гликопротеинами и протеогликанами). Фосфорилирование белков (Существует как механизм регуляции биологической активности белков). Регуляция трансляции: 1) Основанная на сродстве иРНК к рибосомам и факторам инициации трансляции 2) С помощью белков – репрессоров, которые связываются с иРНК, тем самым блокируя инициацию трансляции.
Причины нарушений генеза белков. Роль характера питания, эндогенных факторов в изменении скорости их синтеза.
Причинами нарушения синтеза белка являются: 1) Недостаточное кол-во аминокислот (например, в следствии голодания или диеты без содержания должного кол-ва белков) 2) Дефицит энергии (так как матричные биосинтезы проходят с затратой большого кол-во энергии) 3) Нарушение в работе гормонов (Инсулин – анаболитический гормон, повышает активность всех синтезов, СТГ, тиреоидные гормоны – вызывают усиление транскрипции или трансляции (Но если они в норме, так как при гипертиреозе идет распад) 4) Нарушение самих процессов транскрипции и трансляции – связаны с мутациями.
Для всех живых организмов характерна единая система записи генетической информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов – она называется генетический код. Триплетность - одну аминокислоту кодируют три нуклеотида (кодон). Исключения: УAA, УAГ, УГA не кодируют ни одну из аминокислот (терминирующие или стоп- кодоны). Вырожденность – большинство число аминокислот кодируется несколькими кодонами Универсальность – одинаковое кодирование аминокислот вне зависимости от уровня организации объекта Непрерывность - отсутствие сигналов, указывающих на конец одного кодона и начало другого нуклеотида. Однозначность – каждый триплет кодирует только 1 аминокислоту. Неперекрываемость – нуклеотид одного кодона не может быть нуклеотидом другого кодона. По изменению генотипа мутации бывают генные, хромосомные и геномные. Генные мутации: затрагивают, как правило, один или несколько нуклеотидов, при этом один нуклеотид может превратиться в другой, может выпасть (делеция), продублироваться, а группа нуклеотидов может развернуться на 180 градусов. Например, широко известен ген человека, ответственный за серповидно-клеточную анемию, который может привести к летальному исходу. Хромосомные мутации приводят к изменению числа, размеров и организации хромосом. Геномные мутации - Главная отличительная черта геномных мутаций связана с нарушением числа хромосом в кариотипе.
АЗОТИСТЫЙ ОБМЕН
Белки бывают как животного происхождения, так и растительного. Полноценные пищевые белки – это животного происхождения, содержат в своём составе все аминокислоты в необходимых пропорциях и хорошо усваиваются организмом. Неполноценные белки - растительного происхождения, не содержат, или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Норма белка для взрослых 100-120 г, для детей 55 – 70. Биологическая ценность белков определяется: 1) Близость аминокислотного состава пищевого белка к аминокислотному составу белков тела человека 2) Степень усвоения пищевого белка – эффективность его распада. 3) Содержанием в белках незаменимых аминокислот (их 8, но еще к ним относят аргинин и гистидин (частично заменимые), так как они синтезируется организмом в малых кол-вах). Также выделяют группу условно заменимых аминокислот, тирозин и цистеин, которые синтезируются из незаменимых. Азотистый баланс – соотношение поступившего в организм азота (в виде азота аминокислот) и выведенного азота (в виде конечных продуктов обмена – мочевины и солей аммония). Виды азотистого баланса: «положительный» – если азота выведено меньше, чем введено. «нулевой» – азотистое равновесие. «отрицательный» – если азота выведено больше, чем введено. Это значит, что в организме идет распад белков органов и тканей.
Пищевые источники: Животного происхождения и растительного. Расщепление белков до аминокислот начинается в желудке. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. К ферментам желудка относят пепсин и гастриксин, у детей это реннин. Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин стимулирует главные, добавочные и обкладочные клетки, что вызывает секрецию желудочного сока, в большей мере HCl, также обеспечивает секрецию гистамина. Гистамин, образующийся в фундальных железах, также действует на клетки желудка, стимулируя секрецию HCl. При нарушении нормальной секреции HCl возникают
гипоацидный или гиперацидный гастрит. Функции соляной кислот: 1) Денатурация белков пищи. 2)Бактерицидное действие. 3)Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы. 4) Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты - тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться. 5) Превращение неактивного пепсиногена в активный пепсин. 6) Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина. 7) После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи. Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи. Сок поджелудочной железы – содержит проферменты: Трипсиноген, химотрипсиноген, прокарбоксипептидазы, и проэластазу. Первым активируется трипсин, путем частичного протеолиза, а остальные проферменты панкреатического сока активируются трипсином. Ферменты эпителия тонкой кишки (Аминопептидазы, ди- и трипептидазы) синтезируются в энтероцитах сразу в активной форме. Ферменты, участвующие в переваривании белков в кишечнике, обладают субстратной специфичностью к определенным аминокислотам в белке: Трипсин гидролизует преимущественно пептидные связи, образованные карбоксильными группами катионогенных (основных) аминокислот. Химотрипсин - пептидные связи, образованные карбоксильными группами ароматических аминокислот. Эластаза - связь между -Гли-Ала-. Карбоксипептидазы отщепляют карбоксильные группы, аминопептидазы –
-
Трансляция, характеристика основных фаз. Роль рибосом в трансляции. Активация аминокислот и роль тРНК. Посттрансляционный процессинг белков. Регуляция трансляции.
Трансляция – процесс синтеза полипептида по матрице иРНК с участием свободных аминокислот (которые плавают в цитоплазме) в рибосоме. Как и во всех матричных синтезах выделяют 3 этапа: Инициация, элонгация, терминация. Строение центра рибосом: P-центр – пептидальный: Место начала синтеза белка, при инициации здесь находится тРНК с МЕТ, при элонгации тРНК с другими аминокислотами. A-центр – аминоацильный – также находятся тРНК с аминокислотами (на этапе элонгации именно суда будут приходить тРНК с аминокислотами). Стадии синтеза. Инициация: 1) мРНК связывается с малой субъединицей рибосомы, кодон AUG (кодирующий метионин) устанавливается в P -центре. 2)Инициирующая тРНК (несущая метионин) по принципу комплементарности связывается антикодоном с кодоном AUG. 3) Большая субъединица соединяется с малой. Элонгация: циклический процесс, который повторяет первый цикл. Первый цикл элонгации включает 3 шага: 1) Присоединение тРНК с а/к к аминоацильному участку (Антикодон тРНК комплементарен кодону мРНК). 2) Фермент пептидилТФ осуществляет перенос а/к c пептидального участка на аминоацильный к 2 аминокислоте – происходит образование пептидной связи. 3) Фермент транслоказа перемещает мРНК относительно рибосомы так,что первый кодон АУГ оказывается вне рибосомы, второй кодон становится напротив P центра, а напротив А центра оказывается третий кодон. Для всех этих процессов необходима энергия ГТФ.
Т
 ерминация: Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют: 1)Гидролитическое отщепление полипептида от конечной тРНК 2) Отщепление от P центра уже пустой тРНК 3) Диссоциацию рибосомы.
ерминация: Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют: 1)Гидролитическое отщепление полипептида от конечной тРНК 2) Отщепление от P центра уже пустой тРНК 3) Диссоциацию рибосомы. Посттрансляционная модификация белков. После процесса синтеза белков, происходит модификация определенных аминокислотных остатков. Функциональное значение: 1) Обеспечение правильной сборки белков 2) Регуляция активности белков 3) Передача сигнала. Примеры: Образование γ-карбоксиглутаминовой кислоты в белках, образующих комплексы с ионами Cа 2+ : протромбин, остеокальцин. Иодирование остатков Tyr в тиреоглобулине, идущем на синтез тиреоидных гормонов. Отщепление инициирующего Met (эукариоты). Гликолизирование белков (Защита от протеаз, становятся клеточными рецепторами – гликопротеинами и протеогликанами). Фосфорилирование белков (Существует как механизм регуляции биологической активности белков). Регуляция трансляции: 1) Основанная на сродстве иРНК к рибосомам и факторам инициации трансляции 2) С помощью белков – репрессоров, которые связываются с иРНК, тем самым блокируя инициацию трансляции.
- 1 2 3 4 5 6
Причины нарушений генеза белков. Роль характера питания, эндогенных факторов в изменении скорости их синтеза.
Причинами нарушения синтеза белка являются: 1) Недостаточное кол-во аминокислот (например, в следствии голодания или диеты без содержания должного кол-ва белков) 2) Дефицит энергии (так как матричные биосинтезы проходят с затратой большого кол-во энергии) 3) Нарушение в работе гормонов (Инсулин – анаболитический гормон, повышает активность всех синтезов, СТГ, тиреоидные гормоны – вызывают усиление транскрипции или трансляции (Но если они в норме, так как при гипертиреозе идет распад) 4) Нарушение самих процессов транскрипции и трансляции – связаны с мутациями.
-
Генетический код как способ перевода нуклеотидной записи информации в аминокислотную последовательность. Свойства кода. Мутации, факторы, их провоцирующие.
Для всех живых организмов характерна единая система записи генетической информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов – она называется генетический код. Триплетность - одну аминокислоту кодируют три нуклеотида (кодон). Исключения: УAA, УAГ, УГA не кодируют ни одну из аминокислот (терминирующие или стоп- кодоны). Вырожденность – большинство число аминокислот кодируется несколькими кодонами Универсальность – одинаковое кодирование аминокислот вне зависимости от уровня организации объекта Непрерывность - отсутствие сигналов, указывающих на конец одного кодона и начало другого нуклеотида. Однозначность – каждый триплет кодирует только 1 аминокислоту. Неперекрываемость – нуклеотид одного кодона не может быть нуклеотидом другого кодона. По изменению генотипа мутации бывают генные, хромосомные и геномные. Генные мутации: затрагивают, как правило, один или несколько нуклеотидов, при этом один нуклеотид может превратиться в другой, может выпасть (делеция), продублироваться, а группа нуклеотидов может развернуться на 180 градусов. Например, широко известен ген человека, ответственный за серповидно-клеточную анемию, который может привести к летальному исходу. Хромосомные мутации приводят к изменению числа, размеров и организации хромосом. Геномные мутации - Главная отличительная черта геномных мутаций связана с нарушением числа хромосом в кариотипе.
АЗОТИСТЫЙ ОБМЕН
-
Пищевые источники белков. Факторы, определяющие биологическую ценность протеинов. Понятие о заменимых и незаменимых аминокислотах. Азотистый баланс, его виды. Нормы белка в питании для взрослых.
Белки бывают как животного происхождения, так и растительного. Полноценные пищевые белки – это животного происхождения, содержат в своём составе все аминокислоты в необходимых пропорциях и хорошо усваиваются организмом. Неполноценные белки - растительного происхождения, не содержат, или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Норма белка для взрослых 100-120 г, для детей 55 – 70. Биологическая ценность белков определяется: 1) Близость аминокислотного состава пищевого белка к аминокислотному составу белков тела человека 2) Степень усвоения пищевого белка – эффективность его распада. 3) Содержанием в белках незаменимых аминокислот (их 8, но еще к ним относят аргинин и гистидин (частично заменимые), так как они синтезируется организмом в малых кол-вах). Также выделяют группу условно заменимых аминокислот, тирозин и цистеин, которые синтезируются из незаменимых. Азотистый баланс – соотношение поступившего в организм азота (в виде азота аминокислот) и выведенного азота (в виде конечных продуктов обмена – мочевины и солей аммония). Виды азотистого баланса: «положительный» – если азота выведено меньше, чем введено. «нулевой» – азотистое равновесие. «отрицательный» – если азота выведено больше, чем введено. Это значит, что в организме идет распад белков органов и тканей.
-
Пищевые источники белков. Переваривание белков в желудке. Роль гастрина, гистамина, НСl, пепсина, (у детей – ренина).
Пищевые источники: Животного происхождения и растительного. Расщепление белков до аминокислот начинается в желудке. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. К ферментам желудка относят пепсин и гастриксин, у детей это реннин. Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин стимулирует главные, добавочные и обкладочные клетки, что вызывает секрецию желудочного сока, в большей мере HCl, также обеспечивает секрецию гистамина. Гистамин, образующийся в фундальных железах, также действует на клетки желудка, стимулируя секрецию HCl. При нарушении нормальной секреции HCl возникают
гипоацидный или гиперацидный гастрит. Функции соляной кислот: 1) Денатурация белков пищи. 2)Бактерицидное действие. 3)Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы. 4) Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты - тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться. 5) Превращение неактивного пепсиногена в активный пепсин. 6) Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина. 7) После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи. Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
-
Переваривание пептидов в тонком кишечнике. Экзо- и эндопротеазы, место секреции, механизм активации, специфичность действия. Виды всасывания аминокислот в кишечнике. Гниение белков.
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи. Сок поджелудочной железы – содержит проферменты: Трипсиноген, химотрипсиноген, прокарбоксипептидазы, и проэластазу. Первым активируется трипсин, путем частичного протеолиза, а остальные проферменты панкреатического сока активируются трипсином. Ферменты эпителия тонкой кишки (Аминопептидазы, ди- и трипептидазы) синтезируются в энтероцитах сразу в активной форме. Ферменты, участвующие в переваривании белков в кишечнике, обладают субстратной специфичностью к определенным аминокислотам в белке: Трипсин гидролизует преимущественно пептидные связи, образованные карбоксильными группами катионогенных (основных) аминокислот. Химотрипсин - пептидные связи, образованные карбоксильными группами ароматических аминокислот. Эластаза - связь между -Гли-Ала-. Карбоксипептидазы отщепляют карбоксильные группы, аминопептидазы –


