ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 36
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Изоферменты– это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам. ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ1(НННН), ЛДГ2(НННМ), ЛДГ3(ННММ), ЛДГ4(НМММ), ЛДГ5(ММММ). Креатинкиназа (КК) катализирует реакцию образования креатинфосфата. Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. аланинаминотрансферазы (АЛТ) и аспартатаминтрансферазы (АСТ). при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
Общая схема работы фермента: E+S—ES---EP—E + P
Э.Фишервыдвинул гипотезу, согласно которой активный центр фермента взаимодействует с субстратом по принципу комплементарности, т.е. химического и геометрического соответствия, поэтому этот участок молекулы должен быть стабильным, жёстко структурированным и подходить к субстрату как «ключ к замку». Д. Кошландом. cогласно идее исследователя, активный центр фермента является гибкой структурой. Под действием электрофильных (э/ф) или нуклеофильных (н/ф) группировок субстрата данный участок, имея подобные радикалы, способен изменять свою конформацию. Таким способом субстрат наводит энзим на себя, производя при этом в своей молекуле пространственные перестройки (То есть, меняет свою конформацию под фермент)
Зависимость скорости реакции от содержания субстрата: При стабильных значениях энзима скорость процесса с ростом величин субстрата постепенно повышается, достигая определенного максимума (рис.18), при котором дальнейший подъём его содержания практически не оказывает влияния на ход реакции. Влияние концентрации фермента на скорость реакции: Линейная зависимость между этими величинами, когда интенсивность процесса прямопропорциональна количеству присутствующего энзима – чем больше фермента, тем больше скорость реакции. Эффект колебаний температуры: Скорость химической реакции увеличивается в 2 раза за каждые 10 градусов, но так как ферменты белковой природы, выше 43 градусов они денатурируют. Поэтому пик скорости у человека составляет при температуре 36-37 градусов. Связь интенсивности процесса с величинами рН среды: Для каждого энзима характерны оптимальные значения рН среды. Пепсин – достигает пика в кислой среде, каталаза – 7,8, щелочная фосфатаза – 8 – 9.
Существуют два направления воздействия на деятельность энзимов: активация и ингибирование. Регуляция осуществляется с помощью взаимодействия с эффекторами (активаторами или ингибиторами). Аллостерическая регуляция: Если эффектор реагирует с группировками аллостерического центра фермента, провоцируя конформационные изменения в этом участке, что естественно сказывается на пространственной укладке активного центра (ведь это единая полипептидная мицелла). Сдвиги в архитектуре последнего сказываются на комплементарности его к субстрату, повышая или наоборот – понижая его сродство. Белок – белковое взаимодействие: Ассоциация и диссоциация энзима, обладающего четвертичной структурой, служит механизмом регуляции его активности. ( в ассоциированном состоянии – активный, и наоборот) Регуляция путём ковалентной модификации: механизм регуляции активности энзимов с помощью ковалентной модификации в их аминокислотных остатках. Быстрый и широко распространённый способ подобного явления - фосфорилирование/дефосфорилирование
. Частичный протеолиз как способ активации зимогена: профермент – это неактивная форма фермента. Когда активный центр энзима закрыт олигопептидным фрагментом белковой цепи, субстрат не может с ним взаимодействовать. Тогда эти ферменты гидролизуются, отщепляется фрагмент. В результате этого происходит конформационная перестройка и открывается активный центр. Ингибирование: конкурентное (связывание на активном центре/ борьба с субстратом) и неконкурентное (связывается на аллостеричеком центре).
Достижения энзимологии находят все большее применение в медицине, в частности в профилактике, диагностике и лечении болезней. Энзимопатологии (энзимопатии) – это состояния, связанные с патологическим изменением активности биокатализаторов. Первичные (наследственные) энзимопатии обусловлены генетическим дефектом, приводящим к синтезу повреждённого фермента, что снижает его активность. Например, фенилкетонурия связана с мутацией гена фенилаланин-4-монооксигеназы, которая обычно превращает фенилаланин в тирозин. Вторичные (приобретенные) энзимопатии возникают как следствие действия различных факторов (вирусов, токсинов, бактерий, механических повреждений и т.д.), которые нарушают синтез того или иного фермента, условия его работы; например, при поражении печени ухудшается мочевинообразование, и в крови накапливается ядовитый аммиак (гипераммониемия), что служит примером токсической энзимопатии. Энзимодиагностика – это исследование активности ферментов плазмы крови и других биологических жидкостей, клеток тканей, используемое в целях диагностики тех или иных заболеваний. (Пример – ЛДГ) Энзимотерапия основана на использовании биокатализаторов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы энзимов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и другие), содержащие пепсин, трипсин, амилазу
и применяемые в заместительной терапии при нарушениях пищеварительной системы.
Ф + АДФ ------S + АТФ. 3)
-
Механизм действия ферментов. Этапы ферментативного катализа. Теории (модели) ферментативного катализа: Фишера («ключ-замок») и Кошланда (индуцированного соответсвия). Современные представления о механизме действия энзимов (уравнение Михаэлиса-Ментен). Зависимость скорости ферментативной реакции от концентрации субстрата, фермента, кофермента, температуры и рН среды.
Общая схема работы фермента: E+S—ES---EP—E + P
Э.Фишервыдвинул гипотезу, согласно которой активный центр фермента взаимодействует с субстратом по принципу комплементарности, т.е. химического и геометрического соответствия, поэтому этот участок молекулы должен быть стабильным, жёстко структурированным и подходить к субстрату как «ключ к замку». Д. Кошландом. cогласно идее исследователя, активный центр фермента является гибкой структурой. Под действием электрофильных (э/ф) или нуклеофильных (н/ф) группировок субстрата данный участок, имея подобные радикалы, способен изменять свою конформацию. Таким способом субстрат наводит энзим на себя, производя при этом в своей молекуле пространственные перестройки (То есть, меняет свою конформацию под фермент)
Зависимость скорости реакции от содержания субстрата: При стабильных значениях энзима скорость процесса с ростом величин субстрата постепенно повышается, достигая определенного максимума (рис.18), при котором дальнейший подъём его содержания практически не оказывает влияния на ход реакции. Влияние концентрации фермента на скорость реакции: Линейная зависимость между этими величинами, когда интенсивность процесса прямопропорциональна количеству присутствующего энзима – чем больше фермента, тем больше скорость реакции. Эффект колебаний температуры: Скорость химической реакции увеличивается в 2 раза за каждые 10 градусов, но так как ферменты белковой природы, выше 43 градусов они денатурируют. Поэтому пик скорости у человека составляет при температуре 36-37 градусов. Связь интенсивности процесса с величинами рН среды: Для каждого энзима характерны оптимальные значения рН среды. Пепсин – достигает пика в кислой среде, каталаза – 7,8, щелочная фосфатаза – 8 – 9.
-
Виды регуляции ферментативной активности (активация, инактивация). Механизмы регуляции ферментов (по типу ковалентной модификации, частичный протеолиз, ассоциация-диссоциация, аллостерическая регуляция). Ингибирование, виды (конкурентное, неконкурентное, обратимое, необратимое), характеристика. Примеры действия.
Существуют два направления воздействия на деятельность энзимов: активация и ингибирование. Регуляция осуществляется с помощью взаимодействия с эффекторами (активаторами или ингибиторами). Аллостерическая регуляция: Если эффектор реагирует с группировками аллостерического центра фермента, провоцируя конформационные изменения в этом участке, что естественно сказывается на пространственной укладке активного центра (ведь это единая полипептидная мицелла). Сдвиги в архитектуре последнего сказываются на комплементарности его к субстрату, повышая или наоборот – понижая его сродство. Белок – белковое взаимодействие: Ассоциация и диссоциация энзима, обладающего четвертичной структурой, служит механизмом регуляции его активности. ( в ассоциированном состоянии – активный, и наоборот) Регуляция путём ковалентной модификации: механизм регуляции активности энзимов с помощью ковалентной модификации в их аминокислотных остатках. Быстрый и широко распространённый способ подобного явления - фосфорилирование/дефосфорилирование
. Частичный протеолиз как способ активации зимогена: профермент – это неактивная форма фермента. Когда активный центр энзима закрыт олигопептидным фрагментом белковой цепи, субстрат не может с ним взаимодействовать. Тогда эти ферменты гидролизуются, отщепляется фрагмент. В результате этого происходит конформационная перестройка и открывается активный центр. Ингибирование: конкурентное (связывание на активном центре/ борьба с субстратом) и неконкурентное (связывается на аллостеричеком центре).
-
Использование ферментов в медицине (энзимодиагностика, энзимотерапия). Варианты заместительной и вспомогательной терапии. Понятие об энзимопатиях (первичная, вторичная), их обусловленность.
Достижения энзимологии находят все большее применение в медицине, в частности в профилактике, диагностике и лечении болезней. Энзимопатологии (энзимопатии) – это состояния, связанные с патологическим изменением активности биокатализаторов. Первичные (наследственные) энзимопатии обусловлены генетическим дефектом, приводящим к синтезу повреждённого фермента, что снижает его активность. Например, фенилкетонурия связана с мутацией гена фенилаланин-4-монооксигеназы, которая обычно превращает фенилаланин в тирозин. Вторичные (приобретенные) энзимопатии возникают как следствие действия различных факторов (вирусов, токсинов, бактерий, механических повреждений и т.д.), которые нарушают синтез того или иного фермента, условия его работы; например, при поражении печени ухудшается мочевинообразование, и в крови накапливается ядовитый аммиак (гипераммониемия), что служит примером токсической энзимопатии. Энзимодиагностика – это исследование активности ферментов плазмы крови и других биологических жидкостей, клеток тканей, используемое в целях диагностики тех или иных заболеваний. (Пример – ЛДГ) Энзимотерапия основана на использовании биокатализаторов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы энзимов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и другие), содержащие пепсин, трипсин, амилазу
и применяемые в заместительной терапии при нарушениях пищеварительной системы.
БИОЭНЕРГЕТИКА
-
Понятие о метаболизме, его фазах; их диалектическое единство. Характеристика стадий катаболизма. Роль ацетил-КоА и ПВК как ключевых субстратов общих путей распада, их судьба в организме (участие в катаболизме и анаболизме).
Обмен веществ (метаболизм) - совокупность многочисленных химических реакций, протекающих в живых организмах, благодаря которым осуществляется их рост, жизнедеятельность, воспроизводство, постоянный контакт и обмен с окружающей средой. Главная задача метаболизма - обеспечить организм энергией за счет окисления пищевых веществ. Метаболизм – 2 фазы: Анаболизм – синтез, и катаболизм – распад. В процессе катаболических превращений выделяют три этапа: 1)Гидролитическая стадия – Биополимеры распадаются путем гидролиза до мономеров. 2) Специфический распад – все продукты первой стадии с помощью ферментов распадаются до ПВК и ацетил – КоА. Выделяется 1/3 от всей энергии. Высшие ЖК распадаются до ацетил-КоА и метаболитов ЦТК. (Еще первую и вторую стадию называют специфическими путями катаболизма) 3) Неспецифический распад (Общие пути катаболизма) – окончательное разрушение всех веществ с образованием CO2 и H2O. Этап включает следующие процессы: Окислительное декарбоксилирование ПВК, ЦТК, Сопряженное биологическое окисление и окислительное фосфорилирование. Ацетил KoA служит субстратом для синтеза кетоновых тел, ТАГ, ЖК, холестерина, а также субстратом для ЦТК. ПВК – является субстратом для образование ацетил КоА (ПДГК фермент), и оксалоацетата (пируваткарбоксилаза), также из ПВК может образоваться молочная кислота (лактат) под дейсвием ЛДГ. Также из ПВК может заного синтезироваться глюкоза, путем ГНГ.
-
Биологическое окисление и тканевое дыхание (Синонимы), определения, локализация. Общая схема электрон-транспортной цепи (ЭТЦ), строение ее комплексов, участие коферментов. Субстраты, окисляемые I и II комплексами ЭТЦ. Строение АТФ-синтазного комплекса и механизм окислительного фосфорилирования. Связь окислительного фосфорилирования с ЭТЦ. Патохимия биоэнергетических процессов (гипоксия, гиповитаминозы, окислительный стресс, действие разобщителей и ингибиторов в норме и при патологиях).
Биологическое окисление - транспорт протонов и электронов от окисляемого субстрата через ряд промежуточных переносчиков на кислород с последующим образованием воды и высвобождением энергии. Локализуется на внутренней мембране митохондрий. Электрон – транспортная цепь (Дыхательная цепь) включаюет пять комплексов: НАДН-убихинон-редуктазу (Комплекс I), сукцинат-убихинон-редуктазу (Комплекс II), убихинон-цитохром-с-редуктазу (Комплекс Ш), цитохром с-оксидазу (Комплекс IV) и F0-F1 АТФ-синтазу (Комплекс V) Субстраты, окисляемые 1 и 2 комплексом – НАДH+H и FADH2. Первый комплекс является самым большим в дыхателньой цепи. Он катализирует перенос водорода от NADH+H(Который образовался в ходе реакций: а-кетоглутарата, сукцинила КоА, и оксалоацетата) на убихинон. В его состав входят кофермент ФМН и железосерные белки. Второй комплекс осуществляет перенос восстановительных эквивалентов от ФАДН2 (кофермент сукцинатдегидрогеназы, реакция образования фумарата) через Fe-S центры на убихинон. Комплекс Ш: убихинон-цитохром–с-редуктазаосуществляет перенос электронов от восстановленного убихинона (КоQH2) на цитохром с. По итогу КоQH2 окисляется, а цитохром с - восстанавливается. – а в межмембранное пространство выделяется 2H. Комплекс IV: цитохромоксидаза катализирует реакцию окисления восстановленного цитохрома с молекулярным кислородом, сопряженную с трансмембранным переносом протонов. Этот сложный олигомерный белок имеет в своем составе два гема (а и а3) и два иона Сu2+, обозначаемые как Сu2+А и Сu2+В. Электрон, полученный от цитохрома с, переносится на Сu2+А. Двигаясь в направлении от цитоплазматической поверхности вглубь мембраны, электрон перемещается от Сu2+А к гему а и далее к гему а3и Сu2+B – последнему компоненту дыхательной цепи, восстанавливающему О2:
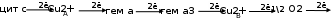
Таким образом, транспорт восстановительных эквивалентов от НАДН к кислороду сопровождается переносом катионов водорода из матрикса в межмембранное пространство, где создается трансмембранный градиент их концентрации. Из за большой разницы в протонах, они будут стремиться вернуться обратно, а обратно вернуться можно только по трансмембранному каналу 5 комплекса. Комплекс V: F0-F1-АТФ-синтаза - сложная молекулярная система, которая может быть разделена на два субкомплекса: факторы F0 и F1. Первый отвечает за транспорт протонов, второй - за синтез (или гидролиз) АТФ. Функционирование Комплекса V происходит следующим образом: действие, совершаемое током протонов через F0 по градиенту их электрохимического потенциала (∆μН+), преобразуется в химическую работу синтеза АТФ, осуществляемую фактором F1. При этом энергия тратится не на образование фосфоангидридной связи между АДФ и Фн, а на «выталкивание» спонтанно возникшего АТФ из активного центра ферментативного комплекса. Патология биоэнергетических процессов: I. Дефицит окисляемого субстрата а) общее или частичное голодание, приводящее к возникновению гипогликемии, недостатку высших жирных кислот б) подавление активности ферментов окислительного декарбоксилирования пирувата в) Угнетение ЦТК г) падение скорости β-окисления высших жирных кислот. II. Наследственные и приобретенные дефекты в работе промежуточных переносчиков ЭТЦ: a) эндогенные или экзогенные гиповитаминозы (никотинамида (витамина РР); рибофлавина (витамина В2) б) блоки системы цитохромовIII. Недостаток кислорода (гипоксия) IV. Наличие разобщителей биологического окисления и фосфорилирования. Разобщители обычно принадлежат к амфифилам – амфипатическим соединениям, имеющим двойственную природу: одна часть молекулы у них неполярна и, следовательно, гидрофобна, вторая - гидрофильная головка представляет реже ион, чаще - полярную структуру. Вследствие этого подобные структуры легко преодолевают все слои мембран. А так как они по большей части способны диссоциировать, то могут служить источниками подвижных протонов, которые и переносятся в сторону их меньшей концентрации.
-
Понятие о свободнорадикальном окислении – механизм образования свободных радикалов. Причины образование АФК (активных форм кислорода), механизмы их повреждающих эффектов. Системы антирадикальной защиты (АРЗ) – ферменты и антиоксиданты (На примерах каталазы, супероксиданиондисмутазы, глутатионпероксидазы и редуктазы, глутатиона и селеноглутатиона, витаминов Е, С, Р и др.).
При полном восстановлении (тканевом дыхании) молекула кислорода, принимая четыре электрона и четыре протона, превращается в две молекулы воды. При неполном восстановлении кислорода образуются различные активные формы. Свободные радикалы появляются в результате тканевого дыхания, переноса кислорода гемоглобином, синтеза гормонов, простагландинов, фагоцитоза, обезвреживания лекарственных препаратов и различных токсических веществ печенью. Образовавшиеся радикальные частицы, прежде всего радикал НО•, обладают чрезвычайно высокой реакционной способностью. Свободные радикалы реагируют практически с любыми молекулами, вызывая нарушение их структуры и функций. Факторы, предотвращающие развитие свободнорадикальных процессов, называют антиоксидантами а)Антиоксиданты ферментативной природы – 1) Супероксиддисмутаза – катализирует реакцию дисмутации супероксид аниона(02 – радикал) с образованием h2o2 и o2. Пероксид водорода может служить предшественником гидроксильных радикалов, поэтому клетка «стремится» контролировать его количество. В деградации Н2О2 участвуют несколько ферментов. Каталаза катализирует его разложение с образованием воды и молекулярного кислорода. Глутатионпероксидазы (в составе содержит селен, клинический показатель для местностей с нехватком селена) восстанавливают h2o2 (h2o2 +2GSH – GS-SG +2h2o) Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2 . Витамин Е (α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от свободного радикального окисления (СРО) Витамин С ингибирует СРО с помощью двух различных механизмов: 1)восстанавливает в мембранах токоферолхинон до витамина Е: 2)взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙ и инактивирует их.
-
Макроэрги, определение, классификация, основные представители, особенности строения роль. Пути синтеза АТФ. Перечислите процессы, в которых используются макроэрги.
Макроэрги – это вещества, в составе которых имеет макроэргическая связь, при разрыве который выделяется большое кол-во энергии. Макроэргические соединения классифицируются по типу связи. Фосфоангидридная связь. Такую связь имеют все нуклеотиды: нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ, УТФ, ТТФ) и нуклеозиддифосфаты (АДФ, ГДФ, ЦДФ, УДФ, ТДФ). 2. Тиоэфирная связь. Примером являются ацил-производные коэнзима А: ацетил-SКоА, сукцинил-SКоА, и другие соединения любой жирной кислоты c HS-КоА. 3. Гуанидинфосфатная связь – присутствует в креатинфосфате, запасном макроэрге мышечной и нервной ткани. 4. Ацилфосфатная связь. К таким макроэргам относится метаболит гликолиза 1,3-дифосфоглицериновая кислота (1,3-дифосфоглицерат). Она обеспечивает синтез АТФ в реакции субстратного фосфорилирования. 5. Енолфосфатная связь. Представитель – фосфоенолпируват, метаболит гликолиза. Он также обеспечивает синтез АТФ в реакции субстратного фосфорилирования в гликолизе. В настоящее время известны три пути синтеза АТФ: 1) Окислительное фосфорилирование. Процесс синтеза АТФ из АДФ и Фн с использованием энергии биологического окисления nАДФ + nФн + Ебио.ок. ------nАТФ. 2)Субстратное фосфорилирование – синтез АТФ при взаимодействии АДФ и другого макроэрга (субстрата: S
Ф): S
Ф + АДФ ------S + АТФ. 3)
БИОЭНЕРГЕТИКА
-
Понятие о метаболизме, его фазах; их диалектическое единство. Характеристика стадий катаболизма. Роль ацетил-КоА и ПВК как ключевых субстратов общих путей распада, их судьба в организме (участие в катаболизме и анаболизме).
Обмен веществ (метаболизм) - совокупность многочисленных химических реакций, протекающих в живых организмах, благодаря которым осуществляется их рост, жизнедеятельность, воспроизводство, постоянный контакт и обмен с окружающей средой. Главная задача метаболизма - обеспечить организм энергией за счет окисления пищевых веществ. Метаболизм – 2 фазы: Анаболизм – синтез, и катаболизм – распад. В процессе катаболических превращений выделяют три этапа: 1)Гидролитическая стадия – Биополимеры распадаются путем гидролиза до мономеров. 2) Специфический распад – все продукты первой стадии с помощью ферментов распадаются до ПВК и ацетил – КоА. Выделяется 1/3 от всей энергии. Высшие ЖК распадаются до ацетил-КоА и метаболитов ЦТК. (Еще первую и вторую стадию называют специфическими путями катаболизма) 3) Неспецифический распад (Общие пути катаболизма) – окончательное разрушение всех веществ с образованием CO2 и H2O. Этап включает следующие процессы: Окислительное декарбоксилирование ПВК, ЦТК, Сопряженное биологическое окисление и окислительное фосфорилирование. Ацетил KoA служит субстратом для синтеза кетоновых тел, ТАГ, ЖК, холестерина, а также субстратом для ЦТК. ПВК – является субстратом для образование ацетил КоА (ПДГК фермент), и оксалоацетата (пируваткарбоксилаза), также из ПВК может образоваться молочная кислота (лактат) под дейсвием ЛДГ. Также из ПВК может заного синтезироваться глюкоза, путем ГНГ.
-
Биологическое окисление и тканевое дыхание (Синонимы), определения, локализация. Общая схема электрон-транспортной цепи (ЭТЦ), строение ее комплексов, участие коферментов. Субстраты, окисляемые I и II комплексами ЭТЦ. Строение АТФ-синтазного комплекса и механизм окислительного фосфорилирования. Связь окислительного фосфорилирования с ЭТЦ. Патохимия биоэнергетических процессов (гипоксия, гиповитаминозы, окислительный стресс, действие разобщителей и ингибиторов в норме и при патологиях).
Биологическое окисление - транспорт протонов и электронов от окисляемого субстрата через ряд промежуточных переносчиков на кислород с последующим образованием воды и высвобождением энергии. Локализуется на внутренней мембране митохондрий. Электрон – транспортная цепь (Дыхательная цепь) включаюет пять комплексов: НАДН-убихинон-редуктазу (Комплекс I), сукцинат-убихинон-редуктазу (Комплекс II), убихинон-цитохром-с-редуктазу (Комплекс Ш), цитохром с-оксидазу (Комплекс IV) и F0-F1 АТФ-синтазу (Комплекс V) Субстраты, окисляемые 1 и 2 комплексом – НАДH+H и FADH2. Первый комплекс является самым большим в дыхателньой цепи. Он катализирует перенос водорода от NADH+H(Который образовался в ходе реакций: а-кетоглутарата, сукцинила КоА, и оксалоацетата) на убихинон. В его состав входят кофермент ФМН и железосерные белки. Второй комплекс осуществляет перенос восстановительных эквивалентов от ФАДН2 (кофермент сукцинатдегидрогеназы, реакция образования фумарата) через Fe-S центры на убихинон. Комплекс Ш: убихинон-цитохром–с-редуктазаосуществляет перенос электронов от восстановленного убихинона (КоQH2) на цитохром с. По итогу КоQH2 окисляется, а цитохром с - восстанавливается. – а в межмембранное пространство выделяется 2H. Комплекс IV: цитохромоксидаза катализирует реакцию окисления восстановленного цитохрома с молекулярным кислородом, сопряженную с трансмембранным переносом протонов. Этот сложный олигомерный белок имеет в своем составе два гема (а и а3) и два иона Сu2+, обозначаемые как Сu2+А и Сu2+В. Электрон, полученный от цитохрома с, переносится на Сu2+А. Двигаясь в направлении от цитоплазматической поверхности вглубь мембраны, электрон перемещается от Сu2+А к гему а и далее к гему а3и Сu2+B – последнему компоненту дыхательной цепи, восстанавливающему О2:
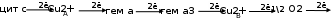
Таким образом, транспорт восстановительных эквивалентов от НАДН к кислороду сопровождается переносом катионов водорода из матрикса в межмембранное пространство, где создается трансмембранный градиент их концентрации. Из за большой разницы в протонах, они будут стремиться вернуться обратно, а обратно вернуться можно только по трансмембранному каналу 5 комплекса. Комплекс V: F0-F1-АТФ-синтаза - сложная молекулярная система, которая может быть разделена на два субкомплекса: факторы F0 и F1. Первый отвечает за транспорт протонов, второй - за синтез (или гидролиз) АТФ. Функционирование Комплекса V происходит следующим образом: действие, совершаемое током протонов через F0 по градиенту их электрохимического потенциала (∆μН+), преобразуется в химическую работу синтеза АТФ, осуществляемую фактором F1. При этом энергия тратится не на образование фосфоангидридной связи между АДФ и Фн, а на «выталкивание» спонтанно возникшего АТФ из активного центра ферментативного комплекса. Патология биоэнергетических процессов: I. Дефицит окисляемого субстрата а) общее или частичное голодание, приводящее к возникновению гипогликемии, недостатку высших жирных кислот б) подавление активности ферментов окислительного декарбоксилирования пирувата в) Угнетение ЦТК г) падение скорости β-окисления высших жирных кислот. II. Наследственные и приобретенные дефекты в работе промежуточных переносчиков ЭТЦ: a) эндогенные или экзогенные гиповитаминозы (никотинамида (витамина РР); рибофлавина (витамина В2) б) блоки системы цитохромовIII. Недостаток кислорода (гипоксия) IV. Наличие разобщителей биологического окисления и фосфорилирования. Разобщители обычно принадлежат к амфифилам – амфипатическим соединениям, имеющим двойственную природу: одна часть молекулы у них неполярна и, следовательно, гидрофобна, вторая - гидрофильная головка представляет реже ион, чаще - полярную структуру. Вследствие этого подобные структуры легко преодолевают все слои мембран. А так как они по большей части способны диссоциировать, то могут служить источниками подвижных протонов, которые и переносятся в сторону их меньшей концентрации.
-
Понятие о свободнорадикальном окислении – механизм образования свободных радикалов. Причины образование АФК (активных форм кислорода), механизмы их повреждающих эффектов. Системы антирадикальной защиты (АРЗ) – ферменты и антиоксиданты (На примерах каталазы, супероксиданиондисмутазы, глутатионпероксидазы и редуктазы, глутатиона и селеноглутатиона, витаминов Е, С, Р и др.).
При полном восстановлении (тканевом дыхании) молекула кислорода, принимая четыре электрона и четыре протона, превращается в две молекулы воды. При неполном восстановлении кислорода образуются различные активные формы. Свободные радикалы появляются в результате тканевого дыхания, переноса кислорода гемоглобином, синтеза гормонов, простагландинов, фагоцитоза, обезвреживания лекарственных препаратов и различных токсических веществ печенью. Образовавшиеся радикальные частицы, прежде всего радикал НО•, обладают чрезвычайно высокой реакционной способностью. Свободные радикалы реагируют практически с любыми молекулами, вызывая нарушение их структуры и функций. Факторы, предотвращающие развитие свободнорадикальных процессов, называют антиоксидантами а)Антиоксиданты ферментативной природы – 1) Супероксиддисмутаза – катализирует реакцию дисмутации супероксид аниона(02 – радикал) с образованием h2o2 и o2. Пероксид водорода может служить предшественником гидроксильных радикалов, поэтому клетка «стремится» контролировать его количество. В деградации Н2О2 участвуют несколько ферментов. Каталаза катализирует его разложение с образованием воды и молекулярного кислорода. Глутатионпероксидазы (в составе содержит селен, клинический показатель для местностей с нехватком селена) восстанавливают h2o2 (h2o2 +2GSH – GS-SG +2h2o) Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2 . Витамин Е (α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от свободного радикального окисления (СРО) Витамин С ингибирует СРО с помощью двух различных механизмов: 1)восстанавливает в мембранах токоферолхинон до витамина Е: 2)взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙ и инактивирует их.
-
Макроэрги, определение, классификация, основные представители, особенности строения роль. Пути синтеза АТФ. Перечислите процессы, в которых используются макроэрги.
Макроэрги – это вещества, в составе которых имеет макроэргическая связь, при разрыве который выделяется большое кол-во энергии. Макроэргические соединения классифицируются по типу связи. Фосфоангидридная связь. Такую связь имеют все нуклеотиды: нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ, УТФ, ТТФ) и нуклеозиддифосфаты (АДФ, ГДФ, ЦДФ, УДФ, ТДФ). 2. Тиоэфирная связь. Примером являются ацил-производные коэнзима А: ацетил-SКоА, сукцинил-SКоА, и другие соединения любой жирной кислоты c HS-КоА. 3. Гуанидинфосфатная связь – присутствует в креатинфосфате, запасном макроэрге мышечной и нервной ткани. 4. Ацилфосфатная связь. К таким макроэргам относится метаболит гликолиза 1,3-дифосфоглицериновая кислота (1,3-дифосфоглицерат). Она обеспечивает синтез АТФ в реакции субстратного фосфорилирования. 5. Енолфосфатная связь. Представитель – фосфоенолпируват, метаболит гликолиза. Он также обеспечивает синтез АТФ в реакции субстратного фосфорилирования в гликолизе. В настоящее время известны три пути синтеза АТФ: 1) Окислительное фосфорилирование. Процесс синтеза АТФ из АДФ и Фн с использованием энергии биологического окисления nАДФ + nФн + Ебио.ок. ------nАТФ. 2)Субстратное фосфорилирование – синтез АТФ при взаимодействии АДФ и другого макроэрга (субстрата: S

