ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 37
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
отщепляют аминогруппы. Дипептидазы – гидролизуют дипептиды до монопептидов. Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы. Выделяют два вида транспорта аминокислот: 1) Путем вторично – активного транспорта за счет градиента концентрации натрия (симпорт). 2) И при помощи γ-глутамилтрансфераза, который находится на мембране энтероцитов. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Гниение – превращения аминокислот, вызванные деятельностью микроорганизмов в толстом кишечнике. Продукты гниения аминокислот являются ксенобиотиками – веществами, чужеродными для организма человека и должны быть обезврежены. Обезвреживание продуктов гниения аминокислот происходит в клетках печени после поступления веществ из кишечника с кровью воротной вены.
К общим путям катаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования.
Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являются биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме. Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное вит. B6). 1) Гистидин – гистамин: Гистамин обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты. 2) Глутамат – ГАМК: тормозный медиатор в центральной нервной системе. 3) Триптофан – серотонин, триптамин: образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации. 4) Тирозин –
дофамин: служит предшественником катехоламинов; является медиатором ингибирующего типа в центральной нервной системе 5) Цистеин – таурин: образуется главным образом в печени; участвует в синтезе парных желчных кислот.
Трансаминирование аминокислот – перенос аминогруппы (NН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В6). Аланин + a-кетоглутарат ----ПВК + глутамат 2) Аспартат + а-кетоглутарат --- оксалоацетат + глутамат. Роль реакций трансаминирования в организме: 1) Участие в непрямом дезаминировании 2) Путь синтеза глутамата (заменимых аминокислот) 3) Образующиеся в реакциях а-кетокислоты (ПВК, оксалоацетат, а-кетоглутарат) включаются в общий путь катаболизма (ПДГК и ЦТК) и ГНГ.
Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода. Фермент реакции глутаматдегидрогеназа, катализирующее прямое окислительное дезаминирование. В качестве кофермента используются НАД+ или НАДФ+ (производные витамина РР). Реакция обратима.
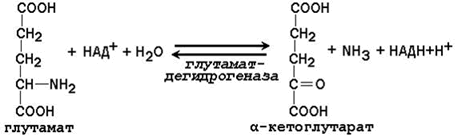
Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа: на первом этапе аминокислота подвергается трансаминированию с образованием глутамата, на втором этапе происходит окислительное дезаминирование глутамата.

При поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ.
Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование. Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН
3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке – тем самым возникает конкуренция с ионными насосами для Na и K. Активное использование глутамата снижает синтез ГАМК – тормозного медиатора. Аммиак также вызывает защелачивание крови, что приводит к увеличенному сродству гемоглобина с кислородом. Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина.
Cинтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком.
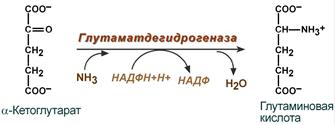
Cинтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
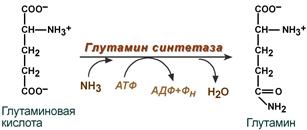
C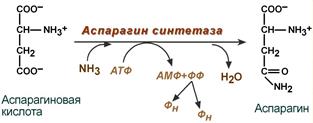 интез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи.
интез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи.
Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака. Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака. Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек. Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот.
Б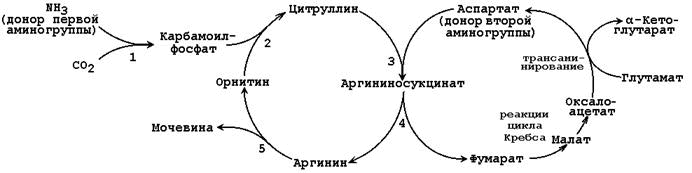 иосинтез мочевины
иосинтез мочевины
– основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени (первые 2 реакции в митохондрии). Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
1) Карбомоилфосфатсинтетаза I (митохондриальная) (с АТФ) 2) Орнитин-карбомоил-ТФ 3) Аргинино-сукцинат-синтетаза (с АТФ) 4) Аргинино-сукцинат – лиаза 5) Аргиназа
Синтез мочевины выше. Связь с ЦТК: 1) Пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе 2) Поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК 3) В цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует. Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4+ в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. (5 реакций – 5 патологий ферментов – значит 5 видов болезней: Гипераммониемия тип 1 и 2, цитрулинэмия, аргининосукцинатурия, гипераргининэмия – соответсвенно в крови будут те метаболиты, в реакциях которых работа ферментов была нарушена).
Фенилаланин относится к незаменимым аминокислотам. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. В организме фенилаланин используется только в синтезе белков, весь неиспользованный запас аминокислоты превращается в тирозин, так как фенилаланил при высоких концентрациях – токсичное соединение.
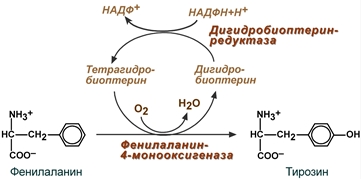
Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигмента меланина.
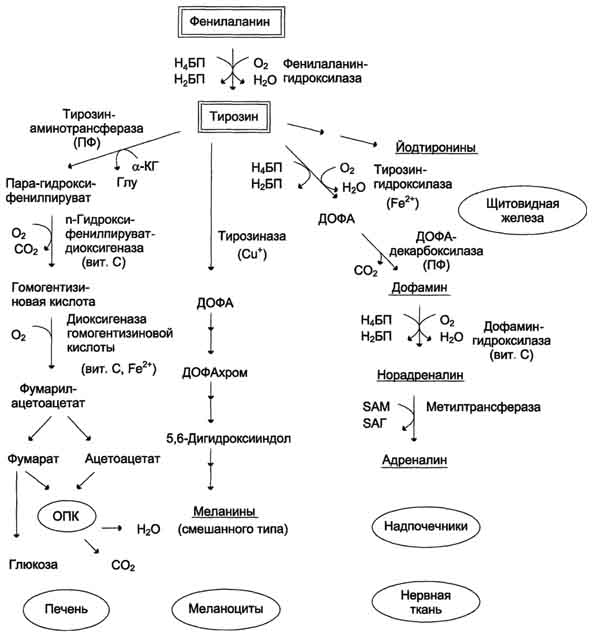
ДОФА – диоксифенилаланин.
Тирозинемия 1 типа – связаны с недостаточность фумарил-ацетоацетат гидролазы – приводя к накоплению фумарил ацетоацетата – токсичное вещество, поражает печень и почки.
Тирозинемия 2 типа – Возникает при недостаточности тирозин-аминотрансферазы. Наблюдается задержка умственного и физического развития. Поражение почек и печени не наблюдается.
Тирозинемия 3 типа – генетический дефект фермента 4-гидроксифенилпируват-диоксигеназы.
Алкаптонурия – нарушение фермента диоксигеназы гомогентизиновой кислоты (гомогентизат-оксидаза) – накоплением гомогентезиновой кислоты, которая на воздухе окисляется и превращается в меланинподобное соединение. Темная моча, окрашенная одежда. В более позднем возрасте – окрас синего цвета, голубой оттенок хрящей. С большим числом накопления этой кислоты, она оседает в соединительных тканях – синие хрящи, артриты и артрозы.
Альбинизм – дефект тирозиназы, нарушение в синтезе меланина. У пациента наблюдается дипегментация всего.
При любых нарушениях превращения фенилаланина в тирозин развивается фенилкетонурия. Заболевание вызвано снижением активности фермента фенилаланин-4-монооксигеназы. Значительное накопление в тканях вызывает ацидоз. Прямое токсическое действие на ЦНС, которое заключается в торможении фенилаланином активности ряда ферментов – пирвуткиназы (окисление глюкозы), тирозиназы (синтез меланина), тирозин-гидроксилазы (катехоламины). От ребенка мышинный запах. Задержка в умственном и физическом развитии. Фенилкетонурия 2 типа связана с нарушением работа фермента дигидробиоптерин редуктазы которая восстанавливает дигидробиоптерин до тетрагидробиоптерина – активная форма, кофермент превращение фенилаланина в тирозин. Проявление в виде тяжелой умственной отсталости, судороги и признаки повышенной возбудимости.
-
Пути использования аминокислот в клетке. Понятия об общих путях катаболизма аминокислот. Реакции декарбоксилирования, образование биогенных аминов (гистамина, ГАМК, триптамина, дофамина), их роль. Реакции дезаминирования, трансаминирования, их биологическая роль. Схемы реакций. Роль витамина В6. Диагностическое значение АЛТ (аланин), АСТ.
К общим путям катаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования.

Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являются биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме. Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное вит. B6). 1) Гистидин – гистамин: Гистамин обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты. 2) Глутамат – ГАМК: тормозный медиатор в центральной нервной системе. 3) Триптофан – серотонин, триптамин: образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации. 4) Тирозин –
дофамин: служит предшественником катехоламинов; является медиатором ингибирующего типа в центральной нервной системе 5) Цистеин – таурин: образуется главным образом в печени; участвует в синтезе парных желчных кислот.
Трансаминирование аминокислот – перенос аминогруппы (NН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В6). Аланин + a-кетоглутарат ----ПВК + глутамат 2) Аспартат + а-кетоглутарат --- оксалоацетат + глутамат. Роль реакций трансаминирования в организме: 1) Участие в непрямом дезаминировании 2) Путь синтеза глутамата (заменимых аминокислот) 3) Образующиеся в реакциях а-кетокислоты (ПВК, оксалоацетат, а-кетоглутарат) включаются в общий путь катаболизма (ПДГК и ЦТК) и ГНГ.
Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода. Фермент реакции глутаматдегидрогеназа, катализирующее прямое окислительное дезаминирование. В качестве кофермента используются НАД+ или НАДФ+ (производные витамина РР). Реакция обратима.

Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа: на первом этапе аминокислота подвергается трансаминированию с образованием глутамата, на втором этапе происходит окислительное дезаминирование глутамата.

При поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ.
-
Аммиак – конечный продукт реакций дезаминирования, механизм его токсического действия, пути обезвреживания. Восстановительное аминирование, образование амидов кислых аминокислот, синтез мочевины (схемы реакций).
Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование. Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН
3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке – тем самым возникает конкуренция с ионными насосами для Na и K. Активное использование глутамата снижает синтез ГАМК – тормозного медиатора. Аммиак также вызывает защелачивание крови, что приводит к увеличенному сродству гемоглобина с кислородом. Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина.
Cинтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком.

Cинтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.

C
 интез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи.
интез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи. Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака. Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака. Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек. Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот.
Б
 иосинтез мочевины
иосинтез мочевины
– основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени (первые 2 реакции в митохондрии). Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
1) Карбомоилфосфатсинтетаза I (митохондриальная) (с АТФ) 2) Орнитин-карбомоил-ТФ 3) Аргинино-сукцинат-синтетаза (с АТФ) 4) Аргинино-сукцинат – лиаза 5) Аргиназа
-
Синтез мочевины, его связь с ЦТК. Гипераммониемии, причины, проявления.
Синтез мочевины выше. Связь с ЦТК: 1) Пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе 2) Поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК 3) В цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует. Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4+ в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. (5 реакций – 5 патологий ферментов – значит 5 видов болезней: Гипераммониемия тип 1 и 2, цитрулинэмия, аргининосукцинатурия, гипераргининэмия – соответсвенно в крови будут те метаболиты, в реакциях которых работа ферментов была нарушена).
-
Фенилаланин и тирозин; химическая природа, схемы обмена этих аминокислот, участие в синтезе БАВ. Генетические дефекты ферментов на примере фенилкетонурии, альбинизма, тирозинемии, алкаптонурии, их проявления.
Фенилаланин относится к незаменимым аминокислотам. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. В организме фенилаланин используется только в синтезе белков, весь неиспользованный запас аминокислоты превращается в тирозин, так как фенилаланил при высоких концентрациях – токсичное соединение.

Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигмента меланина.

ДОФА – диоксифенилаланин.
Тирозинемия 1 типа – связаны с недостаточность фумарил-ацетоацетат гидролазы – приводя к накоплению фумарил ацетоацетата – токсичное вещество, поражает печень и почки.
Тирозинемия 2 типа – Возникает при недостаточности тирозин-аминотрансферазы. Наблюдается задержка умственного и физического развития. Поражение почек и печени не наблюдается.
Тирозинемия 3 типа – генетический дефект фермента 4-гидроксифенилпируват-диоксигеназы.
Алкаптонурия – нарушение фермента диоксигеназы гомогентизиновой кислоты (гомогентизат-оксидаза) – накоплением гомогентезиновой кислоты, которая на воздухе окисляется и превращается в меланинподобное соединение. Темная моча, окрашенная одежда. В более позднем возрасте – окрас синего цвета, голубой оттенок хрящей. С большим числом накопления этой кислоты, она оседает в соединительных тканях – синие хрящи, артриты и артрозы.
Альбинизм – дефект тирозиназы, нарушение в синтезе меланина. У пациента наблюдается дипегментация всего.
При любых нарушениях превращения фенилаланина в тирозин развивается фенилкетонурия. Заболевание вызвано снижением активности фермента фенилаланин-4-монооксигеназы. Значительное накопление в тканях вызывает ацидоз. Прямое токсическое действие на ЦНС, которое заключается в торможении фенилаланином активности ряда ферментов – пирвуткиназы (окисление глюкозы), тирозиназы (синтез меланина), тирозин-гидроксилазы (катехоламины). От ребенка мышинный запах. Задержка в умственном и физическом развитии. Фенилкетонурия 2 типа связана с нарушением работа фермента дигидробиоптерин редуктазы которая восстанавливает дигидробиоптерин до тетрагидробиоптерина – активная форма, кофермент превращение фенилаланина в тирозин. Проявление в виде тяжелой умственной отсталости, судороги и признаки повышенной возбудимости.
-
Триптофан, химическая природа, роль, схема обмена. Генетические дефекты ферментов на примере синдрома «голубых пеленок», болезни Хартнупа, Кнаппа-Комровера, их проявления.

