ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 272
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
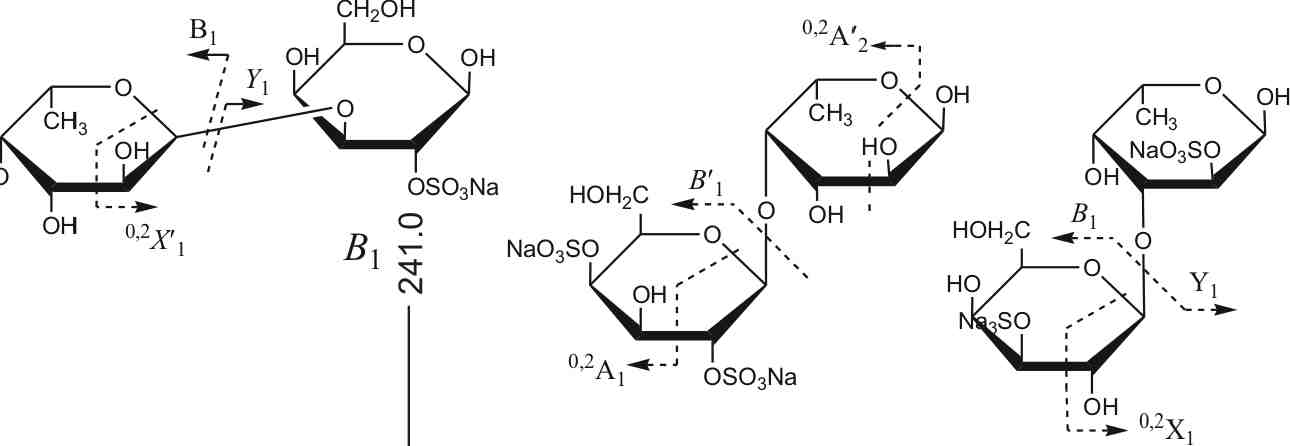
flH-OS03Na-(l->4)-Fuc и Fuc-2-OS03Na-(1^4)-Gal-2-OS03Na. Полученные данные дополняют результаты работы (Anastyuk et al., 2009), в которой мы наблюдали только моносульфатированные остатки галактозы. Стоит отметить, что указанные остатки (рис. 3.25) находились преимущественно на невос-станавливающем конце молекулы. Более протяженные и более сульфа-тированные олигосахариды также были проанализированы с помощью тандемной МАЛДИ МС (Anastyuk et al., 2012). Они были построены из чередующихся 3- и 4-связанных остатков ct-L-Fucp, сульфатированных в положении С2, реже С4 в случае некоторых (1 ^3)-связанных остатков фукозы. (1-»4)-Связанные остатки фукозы преимущественно находились на восстанавливающем конце молекул и были слабо сульфатированы. По всей видимости, в условиях автогидролиза в первую очередь расщепляется именно (1^3)-гликозидная связь, чем и объясняется пре-
100
£50
0 Рис
hso;
0.2
Хп
^0
СП а>
00 О
СО CD
0.2 ,
о см
0,2™
V °-ой
0.2
jj
0,2
х,
[M(2Na)-NaHS04-Na]
B\Y
i * i
AS
JufiH.JijMHLtl
*AkJ}l
100 150 200 250 300 350 400 450 m/z
3.26. Тандемный МАЛДИ масс-спектр иона [Fuc1Gal1(S03Na)2-Na]" с m/z 507.0
90
обладание ионов Сахаров с четной степенью полимеризации в спектре на рис. 3.23. Полученные нами структуры соответствовали структурам, установленным в работе (Bilan et al., 2002), с использованием независимых методов. Таким образом, нами было показано, что использование автогидролиза как альтернативного метода деполимеризации фукоиданов позволяет надежно получать мультисульфатированные олигосахариды, отвечающие фрагментам исходного фукой дана.
В работах (Anastyuk et al., 2010; Anastyuk et al., 2012) нам удалось показать, что использование тандемной МАЛДИ МС не уступает возможностям тандемной ИЭР МС и даже имеет некоторые преимущества: удобнее работать со смесями и интерпретировать тандемные масс-спектры благодаря тому, что источник МАЛДИ продуцирует только однозарядные ионы. Возможность использовать тандемную МАЛДИ МС появилась благодаря специально подобранной нами матрице, с помощью которой удалось добиться минимальной фрагментации исследуемых образцов в ионном источнике.
Заключение
С помощью масс-спектрометрического анализа нами были исследованы структурные особенности фукоиданов из трех видов бурых водорослей: S. gurjanovae, F. evanescens, S. cichorioides. Фукоиданы из S. gurjanovaeи S. cichorioidesбыли исследованы впервые в ТИБОХ ДВО РАН (Шевченко и др., 2007). Для получения олигосахаридов, доступных для масс-спектрометрического анализа, были также впервые разработаны условия деполимеризации фукоиданов различными методами: сольволитическим десульфатированием, автогидролизом и частичным кислотным гидролизом.
Фукоидан из S. gurjanovaeбыл деполимеризован в условиях сольво-литического десульфатирования и частичного кислотного гидролиза. С помощью МАЛДИ масс-спектрометрии среди низкомолекулярных продуктов деполимеризации в процессе сольволиза кроме фукозы [Fuc+Na]+ и [FucSOJ были обнаружены нейтральные фукоолигосахари-ды: [Fucn+Na]+, n=2-ll, сульфатированные фукоолигосахариды [FucnS03], п=2-11, а также смешанные олигосахариды: [Fucn-mGalm+Na]+, n=4-6, m=l-3; [Fucn mGalmS03], n=3-6, m=l-2. Обнаружение смешанных олигосахаридов свидетельствует о блочном строении фукоидана. Протяженность блоков, построенных из фукозы, была достаточно велика и достигала 11, а возможно и более остатков. В продуктах частичного кислотного гидролиза, напротив, преобладали галактозосодержащие олигосахариды: [Galn+Na]+, n=2-5, [GalnS03], n=2-3, причем фукоза в смеси была найдена
91
только в виде ионов мономеров [Fuc+Na]+ и [FuCjSOJ и в составе иона [Fuc Gal SO ]. Размер максимального блока, построенного из галактозы, равен пяти. Интересно отметить, что в условиях кислотного гидролиза более лабильными являются гликозидные связи между остатками де-зоксигексозы (фукозы), а при сольволизе — между остатками галактозы. Впервые, с помощью химических и физико-химических методов было показано, что фукоидан из S. gurjanovaeпредставляет собой галактофукан блочного строения, сульфатированный и частично ацетилированный как по остаткам фукозы, так и галактозы. Размеры блоков, построенных из галактозы, находятся в интервале от двух до пяти, а из фукозы - от двух до одиннадцати. В среднем на 5 остатков фукозы приходилось 2-3 остатка галактозы. Исследуемый фукоидан отличается от аналогичных полисахаридов, выделенных из других видов семейства ламинариевых, которые представляют собой сульфатированные (1^3)-а-Ь-фуканы (Усов, Билан, 2009; Kusaykin et al., 2008), хотя повышенное содержание галактозы отмечалось для фукоиданов из
S. japonica(Zvyagintseva et al., 2003) и S. cichorioides(Yoon et al., 2007).
Фукоидан из бурой водоросли F. evanescens, no одним данным представлял линейную цепь с чередующимися 3- и 4-связанными остатками a-L-Fucp, сульфатированными в положении 2 или много реже 2 и 4. По другим данным фракция фукоидан из F. evanescens также являлся 1^3;1^4-а-Ь-фуканом с преобладанием (1^3)-связанных остатков фукозы (1-»3:1-»4 = 3.5:1) (Kusaykin et al., 2006).
Для деполимеризации выделенного из F evanescens по методу (Kusaykin et al., 2006) фукоидана было применено сольволитическое десульфатиро-вание, в результате которого был получен набор олигосахаридов со степенью полимеризации до 6. Согласно данным масс-спектрометрического анализа (Anastyuk et al., 2009), этот фукоидан содержал протяженные участки, построенные из (1^3)-связанных остатков a-L-Fucp (до трех, и, возможно, более), сульфатированных в основном в положении С2. С помощью тандемной МАЛДИ МС (Anastyuk et al., 2012) нами были получены данные о строении основной цепи, согласующиеся с работой (Bilan et al., 2002), поскольку фукоидан в этом случае был выделен и деполимеризован в более «мягких» условиях. Было показано, что автогидролиз позволяет эффективно получать мультисульфатированные олигосахариды, отвечающие фрагментам фукоидана.
Впервые в фукоидане нами были найдены структурные фрагменты, содержащие остатки ксилозы, галактозы и глюкуроновой кислоты, обнаруженные ранее в моносахаридном составе фукоидана из F. evanescensв минорных количествах. Фрагменты, содержащие глюкуроновую кислоту на
92
восстанавливающем конце, состояли из чередующихся 3- и 4-связанных остатков a-L-Fucp. Полученные данные (Anastyuk et al., 2009) находятся в соответствии с результатами предыдущих исследований (Kusaykin et al., 2006). Кроме того, нами впервые было показано, что остатки ксилозы и галактозы включены в цепь фукоидана. Остаток ксилозы в основном 2-О-сульфатирован и может быть связан (1^4)-связью с остатками ct-L-Fucp. Остатки 2-О-сульфатированной галактозы (до двух) между собой могут быть связаны (1^4)- или (1^3)-связями, а с остатками ct-L-Fucp - (1^4)-связью. Ранее только для фукоидана бурой водоросли Fucusserratusбыло показано (Bilan et al., 2006) наличие (3-(1^4)-связанных остатков ксилозы (до шести), входящих в основную цепь.
Фукоидан из S. cichorioidesисследовался ранее в работах (Zvyagintseva et al., 2003; Yoon et al., 2007). Полученные нами данные согласуются с выводами, сделанными в работе (Zvyagintseva et al., 2003), согласно которым этот фукоидан представляет собой высокосульфатированный (1^3)-а-L-фукан, но находятся в противоречии с результатами, полученными в работе (Yoon et al., 2007), согласно которым фукоидан из
S. cichorioidesпредставляет собой галактофукан (Fuc:Gal2:l), остатки ct-L-фукозы в котором (1^4)-связаны и 2,3-О-дисульфатированы. В условиях автогидролиза, впервые примененного нами для деградации фукоиданов, были получены сульфатированные и нейтральные фукоолигосахариды с максимальной степенью полимеризации (п) до 7. Результаты анализа с помощью ИЭР и МАЛДИ МС/МС сульфатированной a-L-фукозы и фукоолигосахаридов с п=2-3 показали следующее: остатки 2-0- и 4-О-сульфатированной a-L-фукозы были соединены в основном (1^3)-связями. Содержание (1^4)-связанных остатков a-L-фукозы было незначительным. Данные о структурном состоянии остатков гексозы не были получены, поскольку в продуктах деполимеризации фукоидана фрагменты, их содержащие, не были обнаружены.
При интерпретации тандемных масс-спектров сульфатированных олигосахаридов в основном были использованы результаты работ (Tissot В. et al., 2006) и (Daniel R. et al., 2007). Тем не менее, в процессе исследований нами были сделаны следующие уточнения: механизм формирования фрагментов азХ, наблюдаемых во всех сульфатированных фукоолигосаха-ридах, по-видимому, требует наличия сульфатной группы в положениях СЗ (Tissot et al., 2006) или С2 (Daniel et al., 2007), поскольку подобные сигналы не наблюдались в МС/МС спектрах олигосахаридов, содержащих уроновую кислоту на восстанавливающем конце (Anastyuk et al., 2009). На интенсивность сигналов 0,2Х в случае замещения гликозидного гидроксила влияет наличие сульфатной группы в положении С2, так
93
как сигналы 0,2Х для фукоуронидных фрагментов имели более высокую интенсивность, чем для сульфатированных фукоолигосахаридов. Следовательно, при наличии замещенного атома водорода гликозидного гидроксила механизм образования иона 0,2Х для олигосахаридов отличается от предложенного ранее (Minamisawa, Hirabayashi, 2005; Tissot et al., 2006) для сульфатированных моносахаридов. Это наблюдение позволяет точнее по соотношению интенсивностей фрагментов 0,2Х и 0,ЗХ определить положение сульфатной группы.
94
Глава 4. Проблемы стандартизации препаратов полисахаридов бурых водорослей
Стандартизация полисахаридов кажется нам проблематичной по ряду причин: известно, что разные виды бурых водорослей синтезируют существенно различающиеся по строению полисахариды; отдельный вид водоросли синтезирует характерный для него набор полисахаридов, который может содержать несколько структурных типов фукоиданов, равно как ламинаранов и альгиновых кислот; состав и структура полисахаридов может зависеть от вида и сезона сбора водоросли и, по всей видимости, от ее репродуктивного статуса. Условия процессов предобработки водоросли и экстракции полисахаридов также имеют значение при получении биополимеров. Воспроизводимость стандартных характеристик отдельных препаратов очень важна для создания БАД, пищевых добавок и, в особенности, для лекарств. Поэтому нами большое внимание уделено исследованию влияния вышеперечисленных факторов на состав и структуру полисахаридов водорослей.
Влияние эндо- и экзогенных факторов на содержание и структурные характеристики полисахаридов бурых водорослей морей Дальнего Востока России
Сведения о влиянии эндо- и экзогенных факторов на композицию и структуру полисахаридов бурых водорослей чрезвычайно ограничены, особенно это относится к фукоиданам, интерес к которым в настоящее время только возрастает. В последние годы активно изучаются разносторонняя биологическая активность, проявляемая фукоиданами, и возможности их использования для создания лекарственных средств и биологически активных добавок к пище.
Фукоиданы — сульфатированные полисахариды бурых водорослей, представляют собой чрезвычайно структурно разнородную группу. Непременным и часто главным компонентом молекул большинства из них служат остатки a-L-фукозы, этерифицированные серной кислотой. В составе фукоиданов обычно находят другие моносахариды (галактозу, маннозу, ксилозу, рамнозу, глюкуроновую кислоту), а также ацетильные группы. Анализ литературы показывает, что биологические свойства этих полисахаридов связаны с типами фукоиданов, определяемыми структурой их основной цепи, молекулярной массой, содержанием и расположением сульфатных и ацетатных групп (Cumashi et al., 2007; Li et al., 2008).
100
£50
0 Рис
hso;

0.2
Хп
^0
СП а>
00 О
СО CD
0.2 ,
о см
0,2™
V °-ой
0.2
jj
0,2
х,
[M(2Na)-NaHS04-Na]
B\Y
i * i
AS
JufiH.JijMHLtl
*AkJ}l
100 150 200 250 300 350 400 450 m/z
3.26. Тандемный МАЛДИ масс-спектр иона [Fuc1Gal1(S03Na)2-Na]" с m/z 507.0
90
обладание ионов Сахаров с четной степенью полимеризации в спектре на рис. 3.23. Полученные нами структуры соответствовали структурам, установленным в работе (Bilan et al., 2002), с использованием независимых методов. Таким образом, нами было показано, что использование автогидролиза как альтернативного метода деполимеризации фукоиданов позволяет надежно получать мультисульфатированные олигосахариды, отвечающие фрагментам исходного фукой дана.
В работах (Anastyuk et al., 2010; Anastyuk et al., 2012) нам удалось показать, что использование тандемной МАЛДИ МС не уступает возможностям тандемной ИЭР МС и даже имеет некоторые преимущества: удобнее работать со смесями и интерпретировать тандемные масс-спектры благодаря тому, что источник МАЛДИ продуцирует только однозарядные ионы. Возможность использовать тандемную МАЛДИ МС появилась благодаря специально подобранной нами матрице, с помощью которой удалось добиться минимальной фрагментации исследуемых образцов в ионном источнике.
Заключение
С помощью масс-спектрометрического анализа нами были исследованы структурные особенности фукоиданов из трех видов бурых водорослей: S. gurjanovae, F. evanescens, S. cichorioides. Фукоиданы из S. gurjanovaeи S. cichorioidesбыли исследованы впервые в ТИБОХ ДВО РАН (Шевченко и др., 2007). Для получения олигосахаридов, доступных для масс-спектрометрического анализа, были также впервые разработаны условия деполимеризации фукоиданов различными методами: сольволитическим десульфатированием, автогидролизом и частичным кислотным гидролизом.
Фукоидан из S. gurjanovaeбыл деполимеризован в условиях сольво-литического десульфатирования и частичного кислотного гидролиза. С помощью МАЛДИ масс-спектрометрии среди низкомолекулярных продуктов деполимеризации в процессе сольволиза кроме фукозы [Fuc+Na]+ и [FucSOJ были обнаружены нейтральные фукоолигосахари-ды: [Fucn+Na]+, n=2-ll, сульфатированные фукоолигосахариды [FucnS03], п=2-11, а также смешанные олигосахариды: [Fucn-mGalm+Na]+, n=4-6, m=l-3; [Fucn mGalmS03], n=3-6, m=l-2. Обнаружение смешанных олигосахаридов свидетельствует о блочном строении фукоидана. Протяженность блоков, построенных из фукозы, была достаточно велика и достигала 11, а возможно и более остатков. В продуктах частичного кислотного гидролиза, напротив, преобладали галактозосодержащие олигосахариды: [Galn+Na]+, n=2-5, [GalnS03], n=2-3, причем фукоза в смеси была найдена
91
только в виде ионов мономеров [Fuc+Na]+ и [FuCjSOJ и в составе иона [Fuc Gal SO ]. Размер максимального блока, построенного из галактозы, равен пяти. Интересно отметить, что в условиях кислотного гидролиза более лабильными являются гликозидные связи между остатками де-зоксигексозы (фукозы), а при сольволизе — между остатками галактозы. Впервые, с помощью химических и физико-химических методов было показано, что фукоидан из S. gurjanovaeпредставляет собой галактофукан блочного строения, сульфатированный и частично ацетилированный как по остаткам фукозы, так и галактозы. Размеры блоков, построенных из галактозы, находятся в интервале от двух до пяти, а из фукозы - от двух до одиннадцати. В среднем на 5 остатков фукозы приходилось 2-3 остатка галактозы. Исследуемый фукоидан отличается от аналогичных полисахаридов, выделенных из других видов семейства ламинариевых, которые представляют собой сульфатированные (1^3)-а-Ь-фуканы (Усов, Билан, 2009; Kusaykin et al., 2008), хотя повышенное содержание галактозы отмечалось для фукоиданов из
S. japonica(Zvyagintseva et al., 2003) и S. cichorioides(Yoon et al., 2007).
Фукоидан из бурой водоросли F. evanescens, no одним данным представлял линейную цепь с чередующимися 3- и 4-связанными остатками a-L-Fucp, сульфатированными в положении 2 или много реже 2 и 4. По другим данным фракция фукоидан из F. evanescens также являлся 1^3;1^4-а-Ь-фуканом с преобладанием (1^3)-связанных остатков фукозы (1-»3:1-»4 = 3.5:1) (Kusaykin et al., 2006).
Для деполимеризации выделенного из F evanescens по методу (Kusaykin et al., 2006) фукоидана было применено сольволитическое десульфатиро-вание, в результате которого был получен набор олигосахаридов со степенью полимеризации до 6. Согласно данным масс-спектрометрического анализа (Anastyuk et al., 2009), этот фукоидан содержал протяженные участки, построенные из (1^3)-связанных остатков a-L-Fucp (до трех, и, возможно, более), сульфатированных в основном в положении С2. С помощью тандемной МАЛДИ МС (Anastyuk et al., 2012) нами были получены данные о строении основной цепи, согласующиеся с работой (Bilan et al., 2002), поскольку фукоидан в этом случае был выделен и деполимеризован в более «мягких» условиях. Было показано, что автогидролиз позволяет эффективно получать мультисульфатированные олигосахариды, отвечающие фрагментам фукоидана.
Впервые в фукоидане нами были найдены структурные фрагменты, содержащие остатки ксилозы, галактозы и глюкуроновой кислоты, обнаруженные ранее в моносахаридном составе фукоидана из F. evanescensв минорных количествах. Фрагменты, содержащие глюкуроновую кислоту на
92
восстанавливающем конце, состояли из чередующихся 3- и 4-связанных остатков a-L-Fucp. Полученные данные (Anastyuk et al., 2009) находятся в соответствии с результатами предыдущих исследований (Kusaykin et al., 2006). Кроме того, нами впервые было показано, что остатки ксилозы и галактозы включены в цепь фукоидана. Остаток ксилозы в основном 2-О-сульфатирован и может быть связан (1^4)-связью с остатками ct-L-Fucp. Остатки 2-О-сульфатированной галактозы (до двух) между собой могут быть связаны (1^4)- или (1^3)-связями, а с остатками ct-L-Fucp - (1^4)-связью. Ранее только для фукоидана бурой водоросли Fucusserratusбыло показано (Bilan et al., 2006) наличие (3-(1^4)-связанных остатков ксилозы (до шести), входящих в основную цепь.
Фукоидан из S. cichorioidesисследовался ранее в работах (Zvyagintseva et al., 2003; Yoon et al., 2007). Полученные нами данные согласуются с выводами, сделанными в работе (Zvyagintseva et al., 2003), согласно которым этот фукоидан представляет собой высокосульфатированный (1^3)-а-L-фукан, но находятся в противоречии с результатами, полученными в работе (Yoon et al., 2007), согласно которым фукоидан из
S. cichorioidesпредставляет собой галактофукан (Fuc:Gal2:l), остатки ct-L-фукозы в котором (1^4)-связаны и 2,3-О-дисульфатированы. В условиях автогидролиза, впервые примененного нами для деградации фукоиданов, были получены сульфатированные и нейтральные фукоолигосахариды с максимальной степенью полимеризации (п) до 7. Результаты анализа с помощью ИЭР и МАЛДИ МС/МС сульфатированной a-L-фукозы и фукоолигосахаридов с п=2-3 показали следующее: остатки 2-0- и 4-О-сульфатированной a-L-фукозы были соединены в основном (1^3)-связями. Содержание (1^4)-связанных остатков a-L-фукозы было незначительным. Данные о структурном состоянии остатков гексозы не были получены, поскольку в продуктах деполимеризации фукоидана фрагменты, их содержащие, не были обнаружены.
При интерпретации тандемных масс-спектров сульфатированных олигосахаридов в основном были использованы результаты работ (Tissot В. et al., 2006) и (Daniel R. et al., 2007). Тем не менее, в процессе исследований нами были сделаны следующие уточнения: механизм формирования фрагментов азХ, наблюдаемых во всех сульфатированных фукоолигосаха-ридах, по-видимому, требует наличия сульфатной группы в положениях СЗ (Tissot et al., 2006) или С2 (Daniel et al., 2007), поскольку подобные сигналы не наблюдались в МС/МС спектрах олигосахаридов, содержащих уроновую кислоту на восстанавливающем конце (Anastyuk et al., 2009). На интенсивность сигналов 0,2Х в случае замещения гликозидного гидроксила влияет наличие сульфатной группы в положении С2, так
93
как сигналы 0,2Х для фукоуронидных фрагментов имели более высокую интенсивность, чем для сульфатированных фукоолигосахаридов. Следовательно, при наличии замещенного атома водорода гликозидного гидроксила механизм образования иона 0,2Х для олигосахаридов отличается от предложенного ранее (Minamisawa, Hirabayashi, 2005; Tissot et al., 2006) для сульфатированных моносахаридов. Это наблюдение позволяет точнее по соотношению интенсивностей фрагментов 0,2Х и 0,ЗХ определить положение сульфатной группы.
94
Глава 4. Проблемы стандартизации препаратов полисахаридов бурых водорослей
Стандартизация полисахаридов кажется нам проблематичной по ряду причин: известно, что разные виды бурых водорослей синтезируют существенно различающиеся по строению полисахариды; отдельный вид водоросли синтезирует характерный для него набор полисахаридов, который может содержать несколько структурных типов фукоиданов, равно как ламинаранов и альгиновых кислот; состав и структура полисахаридов может зависеть от вида и сезона сбора водоросли и, по всей видимости, от ее репродуктивного статуса. Условия процессов предобработки водоросли и экстракции полисахаридов также имеют значение при получении биополимеров. Воспроизводимость стандартных характеристик отдельных препаратов очень важна для создания БАД, пищевых добавок и, в особенности, для лекарств. Поэтому нами большое внимание уделено исследованию влияния вышеперечисленных факторов на состав и структуру полисахаридов водорослей.
Влияние эндо- и экзогенных факторов на содержание и структурные характеристики полисахаридов бурых водорослей морей Дальнего Востока России
Сведения о влиянии эндо- и экзогенных факторов на композицию и структуру полисахаридов бурых водорослей чрезвычайно ограничены, особенно это относится к фукоиданам, интерес к которым в настоящее время только возрастает. В последние годы активно изучаются разносторонняя биологическая активность, проявляемая фукоиданами, и возможности их использования для создания лекарственных средств и биологически активных добавок к пище.
Фукоиданы — сульфатированные полисахариды бурых водорослей, представляют собой чрезвычайно структурно разнородную группу. Непременным и часто главным компонентом молекул большинства из них служат остатки a-L-фукозы, этерифицированные серной кислотой. В составе фукоиданов обычно находят другие моносахариды (галактозу, маннозу, ксилозу, рамнозу, глюкуроновую кислоту), а также ацетильные группы. Анализ литературы показывает, что биологические свойства этих полисахаридов связаны с типами фукоиданов, определяемыми структурой их основной цепи, молекулярной массой, содержанием и расположением сульфатных и ацетатных групп (Cumashi et al., 2007; Li et al., 2008).

