Файл: 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 87
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
(n-* + 1 өрнегі ненің мөлшерін анықтайды:* иондану деңгейін.
* иондану константасын.
* рН мөлшерін.
*+изотониялық коэффициентін.
* иондарға ыдыраған бөлшектер санын.
! Күшті электролиттер теориясын ұсынған: *+Дебай и Хюккель.
* Вант-Гофф. * Аррениус. * Гиббс.
! Булану кезінде бастапқы заттың құрамы сақталатын ерітінділер: * гомогенді.
*гетерогенді. *тепе – теңдік.
*қайтымды. * +азеотропты.
! Ерітіндінің негізгі коллигативтік қасиетіне жатады:
* ерітіндінің қайнау температурасының жоғарылауы.
* ерітіндінің қату температурасының төмендеуі.
*+қаныққан ерітінді бетіндегі қысымның төмендеуі.
* осмостық қысым.
* қаныққан бу қысымы.
! Эбулиоскопиялық константа Е:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
*+еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
! Криоскопиялық константа К:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
*+еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
IV тарау. Химиялық кинетика.
! H2+Cl2→2HCl реакциясы келесі механизм бойынша жүреді
Cl2→Cl+Cl (баяу)
Сl+H2→HCl +H (жылдам)
Сl+H→HCl (жылдам)
Реакция реті тең болады:*+1.
* 2. * 3. * ½. * 0.
! M2+N2→2MN реакциясы келесі механизм бойынша жүреді
M2→M+M (жылдам)
M+N2→MN+N (баяу)
M+N→MN (жылдам)
Реакция реті тең болады:* 1.
*+2. * 3. * ½. * 0.
! H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
*+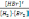
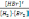 арақатынасымен анықталады.
арақатынасымен анықталады.
*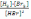
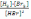 арақатынасымен анықталады.
арақатынасымен анықталады.
*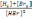
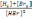 арақатынасымен анықталады.
арақатынасымен анықталады.
* Өлшемсіз. * Өлшем бірлігі-моль*л-1.
!. Егер жылдамдық үшін теңдеу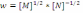
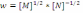
түрінде жазылса, онда реакция ретін анықтаңыз:
*+0. * ½. * 1. * 1,5. * 2.
!. Химиялық реакцияның жылдамдық теңдеуі бойынша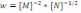
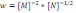 оның ретін анықтаңыз:*+-2,5. * 1,5. * 1. * -1,5. * -1.
оның ретін анықтаңыз:*+-2,5. * 1,5. * 1. * -1,5. * -1.
! Химиялық реакцияның жылдамдық теңдеуі бойынша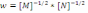
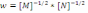 оның ретін анықтаңыз:* -3,5. * 0,25. *+1. * -1,5. * -1.
оның ретін анықтаңыз:* -3,5. * 0,25. *+1. * -1,5. * -1.
! 2А+В=2С реакция үшін:
*+Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A*CB.
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A+CB.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2С.
! 2А+В=2С реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
*+W=kC2A*CB. * W=kC2A+CB.
* W=kCA*CB. * W=kCA+CB. * W=C2A*CB.
! 2СО +О2=2СО2 реакция үшін:
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO+Co2.
*+Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO*Co2.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2co3.
!. 2CO +O2=2CO2 реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
* W=kC2CO+Co2. * W=kC2CO*Co2.
*+W=kC2co2. * W= C2co2. * W= kCco2.
!. Температураны 250С-тен 45 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:* 6 есе артады.
* 6 есе кемиді. *+9 есе артады.
* 9 есе кемиді.
* Өзгермейді.
!. Температураны 50 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=2 болса:*+32 есе артады.
* 32 есе кемиді. * 8 есе артады.
* 8 есе кемиді. * Өзгермейді.
!. Температураны 400С-ға төмендесе реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:* 12 есе артады.
* 12 есе кемиді. * 81 есе артады.
*+81 есе кемиді * Өзгермейді.
! Егер ұсынылған стехиометриялық реакция теңдеуі 2CO +O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:* 0. * 1.
* -3. * 2. *+3.
!. Егер ұсынылған стехиометриялық реакция теңдеуі 2NO +O2=2NO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:* 0. * 1. * 2.
*+3. * 4.
!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:
* Өзгермейді. * 4 есе арталы.
*+8 есе артады. * 6 есе артады.
* 8 есе кемиді.
!. Ыдыстың көлемін 3 есе азайтса, 2CO +O2=2CO2 реакция жылдамдығы:
* Өзгермейді. * 9 есе артады.
* 9 есе кемиді. *+27 есе артады.
* 27 есе кемиді.
!. Реакция зонасында қысымды 3 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:* 32 есе артады.
* 9 есе артады. * 9 есе кемиді.
*+27 есе артады. * 27 есе кемиді.
!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
* Өзгермейді. * 2 есе артады.
*+8 есе артады. * 6 есе артады.
* 8 есе кемиді.
!. Ыдыстың көлемін 3 есе азайтса, 2NO +O2=2NO2 реакция жылдамдығы:
* Өзгермейді. *+9 есе артады.
* 6 есе кемиді. * 27 есе артады.
* 54 есе кемиді.
!. Реакция зонасында қысымды 3 есе арттырса, , 2NO +O2=2NO2 реакция жылдамдығы:* 32 есе артады.
* 6 есе артады. * 9 есе кемиді.
*+27 есе артады. * 54 есе кемиді.
! Әрекеттесуші заттардың концентрациясының уақыт бірлігінде өзгертетін графикалық тәуелділігі аталады:* Беттік керілуі изотермасы.
*+Кинетикалық қисық.
* Реакцияның энергетикалық профилі.
* Титрлеу қисығы.
* Адсорбсия изотермасы.
!. Реагенттер концентрациясының химиялық реакция жылдамдығына сандық тұрғыдан әсерін сипаттайды:* Рауль заңы.
* Гесс заңы. * Аррениус теңдеуі.
* Вант-Гофф ережесі.
*+Әрекеттесуші масалар заңы.
!. Әрекеттесуші масалар заңының авторлары:* Менделеев және Клапейрон.
* Клапейрон және Клаузиус.
*+Гульберг және Вааге.
* Шульц және Гарди.
* Гендерсон және Гассельбах.
! химиялық реакция жылдамдығының температураға тәуелділігі анықталады:
* Вант-Гофф ересімен.
* Михаэлиса- Ментен теңдеуімен.
*+Аррениус теңдеуімен.
* Шульце-Гарди ережесімен.
* Әрекеттесуші масалар заңы.
!. Ле- Шатель принципіне сәйкес Н2 +І2=2НІ реакциясын тепе-тендік оңға жылжиды, егер:
*+ Сутектің және йодтың концентрацияларын арттырса.
* Сутектің концентрациясын азайтса.
* Иодтың концентрациясын арттырса.
* Иодтың концентрациясын азайтса.
* Иодсутектің реакция зонасын бөлі шығарса.
!. Оттектің концентрациясын екі есе арттырса С(т)+ О2(т) =СО2(т) реакция жылдамдығы:* Өзгермейді.
*+2 есе артады. * 3 есе артады.
* 4 есе артады. * 6 есе артады.
!. СО концентрациясын 2 есе арттырса, 2СО +О2=2СО реакция жылдамдығы:
* 2 есе артады. * 3 есе артады.
* 6 есе кемиді. *+4 есе артады.
* Өзгермейді.
!. Реакция жылдамдығы тұрақтысының температураға тәуелділігін теңдеу:
* k= AEa/RT. * k= AEaRT.
*+Ink= In A – Ea/RT. * Ink=In A - Ea RT.
* Ink=In A + Ea RT.
!. Катализатор қатысында химиялық реакцияның жылдамдығы артады:
* Ішкі энергияның азаюы арқылы.
* Энтальпияның азаюы арқылы.
*+Активтендіру энергиясының азаюы арқылы.
* Энтропияның артуы арқылы.
* Активтендіру энергиясының артуы арқыл.
! w=-dC/dt өрнегі білдіреді:
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
0>0>0>
*+бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
* екінші ретті реакция жылдамдығын.
! w=+dC/dt өрнегі білдіреді:
*реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын орташа жылдамдығын.
*+реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*нөлінші ретті реакция жылдамдығын.
! Химиялық реакцияның молекулалылығы:
*+тек бүтін сан.
*нөлге тен болуы мүмкін.
*бөлшек сан болуы мүмкін.
*2-лен артық болмауы тиіс.
*бөлшек сан болмауы мүмкін.
! Реакция жылдамдығының тұрақтысы тәуелді болады:*Массаға. *Салмаққа.
*+температураға. *Уақытқа.
*зат мөлшеріне.
! Егер химиялық реакция жылдамдығы әрекеттесуші заттар концентрациясына тәуелсіз болса,онда реакция реті тең болады:*3. *½. *+0. *2. *1.
! Реакция жылдамдығының теңдеуі W=K[A]1\2 [B]-1 түрінде өрнектелсе реакцияны анықтаңыз:*+ -1/2. *2.5.
*0. *1. *Анықталынбайды.
! Қандай ретті реакция үшін реакция жылдамдығы мен реакция жылдамдығының константасының өлшем бірлігі бірдей:*+нөлінші. *Бірінші.
*Екінші. *Үшінші.
*ондай болуы мүмкін емес.
! Катализатор:
*кері реакция тепе-тендік куйін ығыстырады.
*реакциянын активтендіру энергиясын арттырады.
*+реакциянын активтендіру энергиясын төмендетеді.
*реакциянын аяқталғанда өзгеріссіз қалады.
*тура ж/е кері реакцинын жылдамдығын бірдей дәрежеде арттырады.
! Катализатор әсерінен химиялық реакцияда өзгереді:
*реакция өнімдерінің құрамы.
*тепе-тендік күйі.
*тепе-тендік концетрациялары.
*реакция бағыты.
*+активтендіру энергиясы.
! Нөлінші ретті реакция жылдамдығы тәуелді емес:*Теипература.
*реагенттер табиғатына.
*катализатор қатысуына.
*+реагенттер коецетрациясына.
*аталған барлық факторларға.
! Бірінші ретті реакция жылдамдығының тұрақтысын көрсетіңіз, егер жартылай ыдырау уақыты 240с болса:
*1,44 10 -3 с -1. *+2,88 10 -3 с -1.
*0,72-10-3 с -1. *1,44 с
* иондану константасын.
* рН мөлшерін.
*+изотониялық коэффициентін.
* иондарға ыдыраған бөлшектер санын.
! Күшті электролиттер теориясын ұсынған: *+Дебай и Хюккель.
* Вант-Гофф. * Аррениус. * Гиббс.
! Булану кезінде бастапқы заттың құрамы сақталатын ерітінділер: * гомогенді.
*гетерогенді. *тепе – теңдік.
*қайтымды. * +азеотропты.
! Ерітіндінің негізгі коллигативтік қасиетіне жатады:
* ерітіндінің қайнау температурасының жоғарылауы.
* ерітіндінің қату температурасының төмендеуі.
*+қаныққан ерітінді бетіндегі қысымның төмендеуі.
* осмостық қысым.
* қаныққан бу қысымы.
! Эбулиоскопиялық константа Е:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
*+еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
! Криоскопиялық константа К:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
*+еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
IV тарау. Химиялық кинетика.
! H2+Cl2→2HCl реакциясы келесі механизм бойынша жүреді
Cl2→Cl+Cl (баяу)
Сl+H2→HCl +H (жылдам)
Сl+H→HCl (жылдам)
Реакция реті тең болады:*+1.
* 2. * 3. * ½. * 0.
! M2+N2→2MN реакциясы келесі механизм бойынша жүреді
M2→M+M (жылдам)
M+N2→MN+N (баяу)
M+N→MN (жылдам)
Реакция реті тең болады:* 1.
*+2. * 3. * ½. * 0.
! H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
*+
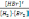
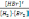 арақатынасымен анықталады.
арақатынасымен анықталады.*
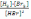
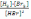 арақатынасымен анықталады.
арақатынасымен анықталады.*
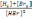
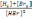 арақатынасымен анықталады.
арақатынасымен анықталады.* Өлшемсіз. * Өлшем бірлігі-моль*л-1.
!. Егер жылдамдық үшін теңдеу
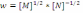
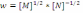
түрінде жазылса, онда реакция ретін анықтаңыз:
*+0. * ½. * 1. * 1,5. * 2.
!. Химиялық реакцияның жылдамдық теңдеуі бойынша
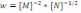
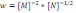 оның ретін анықтаңыз:*+-2,5. * 1,5. * 1. * -1,5. * -1.
оның ретін анықтаңыз:*+-2,5. * 1,5. * 1. * -1,5. * -1.! Химиялық реакцияның жылдамдық теңдеуі бойынша
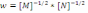
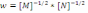 оның ретін анықтаңыз:* -3,5. * 0,25. *+1. * -1,5. * -1.
оның ретін анықтаңыз:* -3,5. * 0,25. *+1. * -1,5. * -1.! 2А+В=2С реакция үшін:
*+Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A*CB.
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A+CB.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2С.
! 2А+В=2С реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
*+W=kC2A*CB. * W=kC2A+CB.
* W=kCA*CB. * W=kCA+CB. * W=C2A*CB.
! 2СО +О2=2СО2 реакция үшін:
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO+Co2.
*+Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO*Co2.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2co3.
!. 2CO +O2=2CO2 реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
* W=kC2CO+Co2. * W=kC2CO*Co2.
*+W=kC2co2. * W= C2co2. * W= kCco2.
!. Температураны 250С-тен 45 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:* 6 есе артады.
* 6 есе кемиді. *+9 есе артады.
* 9 есе кемиді.
* Өзгермейді.
!. Температураны 50 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=2 болса:*+32 есе артады.
* 32 есе кемиді. * 8 есе артады.
* 8 есе кемиді. * Өзгермейді.
!. Температураны 400С-ға төмендесе реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:* 12 есе артады.
* 12 есе кемиді. * 81 есе артады.
*+81 есе кемиді * Өзгермейді.
! Егер ұсынылған стехиометриялық реакция теңдеуі 2CO +O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:* 0. * 1.
* -3. * 2. *+3.
!. Егер ұсынылған стехиометриялық реакция теңдеуі 2NO +O2=2NO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:* 0. * 1. * 2.
*+3. * 4.
!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:
* Өзгермейді. * 4 есе арталы.
*+8 есе артады. * 6 есе артады.
* 8 есе кемиді.
!. Ыдыстың көлемін 3 есе азайтса, 2CO +O2=2CO2 реакция жылдамдығы:
* Өзгермейді. * 9 есе артады.
* 9 есе кемиді. *+27 есе артады.
* 27 есе кемиді.
!. Реакция зонасында қысымды 3 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:* 32 есе артады.
* 9 есе артады. * 9 есе кемиді.
*+27 есе артады. * 27 есе кемиді.
!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
* Өзгермейді. * 2 есе артады.
*+8 есе артады. * 6 есе артады.
* 8 есе кемиді.
!. Ыдыстың көлемін 3 есе азайтса, 2NO +O2=2NO2 реакция жылдамдығы:
* Өзгермейді. *+9 есе артады.
* 6 есе кемиді. * 27 есе артады.
* 54 есе кемиді.
!. Реакция зонасында қысымды 3 есе арттырса, , 2NO +O2=2NO2 реакция жылдамдығы:* 32 есе артады.
* 6 есе артады. * 9 есе кемиді.
*+27 есе артады. * 54 есе кемиді.
! Әрекеттесуші заттардың концентрациясының уақыт бірлігінде өзгертетін графикалық тәуелділігі аталады:* Беттік керілуі изотермасы.
*+Кинетикалық қисық.
* Реакцияның энергетикалық профилі.
* Титрлеу қисығы.
* Адсорбсия изотермасы.
!. Реагенттер концентрациясының химиялық реакция жылдамдығына сандық тұрғыдан әсерін сипаттайды:* Рауль заңы.
* Гесс заңы. * Аррениус теңдеуі.
* Вант-Гофф ережесі.
*+Әрекеттесуші масалар заңы.
!. Әрекеттесуші масалар заңының авторлары:* Менделеев және Клапейрон.
* Клапейрон және Клаузиус.
*+Гульберг және Вааге.
* Шульц және Гарди.
* Гендерсон және Гассельбах.
! химиялық реакция жылдамдығының температураға тәуелділігі анықталады:
* Вант-Гофф ересімен.
* Михаэлиса- Ментен теңдеуімен.
*+Аррениус теңдеуімен.
* Шульце-Гарди ережесімен.
* Әрекеттесуші масалар заңы.
!. Ле- Шатель принципіне сәйкес Н2 +І2=2НІ реакциясын тепе-тендік оңға жылжиды, егер:
*+ Сутектің және йодтың концентрацияларын арттырса.
* Сутектің концентрациясын азайтса.
* Иодтың концентрациясын арттырса.
* Иодтың концентрациясын азайтса.
* Иодсутектің реакция зонасын бөлі шығарса.
!. Оттектің концентрациясын екі есе арттырса С(т)+ О2(т) =СО2(т) реакция жылдамдығы:* Өзгермейді.
*+2 есе артады. * 3 есе артады.
* 4 есе артады. * 6 есе артады.
!. СО концентрациясын 2 есе арттырса, 2СО +О2=2СО реакция жылдамдығы:
* 2 есе артады. * 3 есе артады.
* 6 есе кемиді. *+4 есе артады.
* Өзгермейді.
!. Реакция жылдамдығы тұрақтысының температураға тәуелділігін теңдеу:
* k= AEa/RT. * k= AEaRT.
*+Ink= In A – Ea/RT. * Ink=In A - Ea RT.
* Ink=In A + Ea RT.
!. Катализатор қатысында химиялық реакцияның жылдамдығы артады:
* Ішкі энергияның азаюы арқылы.
* Энтальпияның азаюы арқылы.
*+Активтендіру энергиясының азаюы арқылы.
* Энтропияның артуы арқылы.
* Активтендіру энергиясының артуы арқыл.
! w=-dC/dt өрнегі білдіреді:
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
0>0>0>
*+бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
* екінші ретті реакция жылдамдығын.
! w=+dC/dt өрнегі білдіреді:
*реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын орташа жылдамдығын.
*+реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*нөлінші ретті реакция жылдамдығын.
! Химиялық реакцияның молекулалылығы:
*+тек бүтін сан.
*нөлге тен болуы мүмкін.
*бөлшек сан болуы мүмкін.
*2-лен артық болмауы тиіс.
*бөлшек сан болмауы мүмкін.
! Реакция жылдамдығының тұрақтысы тәуелді болады:*Массаға. *Салмаққа.
*+температураға. *Уақытқа.
*зат мөлшеріне.
! Егер химиялық реакция жылдамдығы әрекеттесуші заттар концентрациясына тәуелсіз болса,онда реакция реті тең болады:*3. *½. *+0. *2. *1.
! Реакция жылдамдығының теңдеуі W=K[A]1\2 [B]-1 түрінде өрнектелсе реакцияны анықтаңыз:*+ -1/2. *2.5.
*0. *1. *Анықталынбайды.
! Қандай ретті реакция үшін реакция жылдамдығы мен реакция жылдамдығының константасының өлшем бірлігі бірдей:*+нөлінші. *Бірінші.
*Екінші. *Үшінші.
*ондай болуы мүмкін емес.
! Катализатор:
*кері реакция тепе-тендік куйін ығыстырады.
*реакциянын активтендіру энергиясын арттырады.
*+реакциянын активтендіру энергиясын төмендетеді.
*реакциянын аяқталғанда өзгеріссіз қалады.
*тура ж/е кері реакцинын жылдамдығын бірдей дәрежеде арттырады.
! Катализатор әсерінен химиялық реакцияда өзгереді:
*реакция өнімдерінің құрамы.
*тепе-тендік күйі.
*тепе-тендік концетрациялары.
*реакция бағыты.
*+активтендіру энергиясы.
! Нөлінші ретті реакция жылдамдығы тәуелді емес:*Теипература.
*реагенттер табиғатына.
*катализатор қатысуына.
*+реагенттер коецетрациясына.
*аталған барлық факторларға.
! Бірінші ретті реакция жылдамдығының тұрақтысын көрсетіңіз, егер жартылай ыдырау уақыты 240с болса:
*1,44 10 -3 с -1. *+2,88 10 -3 с -1.
*0,72-10-3 с -1. *1,44 с
