Файл: Тема Основные химические понятия и законы химии Ключевые понятия атом.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.05.2024
Просмотров: 67
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Тема 3. Химическая связь. Строение вещества
Тема 4. Растворы. Электролитическая диссоциация
Тема 5. Классификация неорганических соединений
1. Простые и сложные вещества.
1. Классификация химических реакций.
2. Окислительно-восстановительные реакции.
3. Скорость химических реакций.
4. Необратимые и обратимые реакции. Химическое равновесие.
Тема 8. Основные понятия органической химии и теория строения
Тема 9. Углеводороды и их природные источники
Тема 10. Кислородсодержащие органические соединения
Вопросы для самопроверки:
-
От чего зависит относительная электроотрицательносить? Электроотрицательность атомов элементов изменяется постепенно: в периодах периодической системы слева направо ее значение возрастает, а в группах сверху вниз — уменьшается. -
Назовите виды химической связи. Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной. Ионная связь возникает между атомами, электроотрицательность которых резко различается. Металлическая связь существует в металлах в твердом в жидком состоянии. -
Какова схема образования ионной связи? Na–lе Na+ - ион натрия, получена устойчивая восьми электронная 1s22s22p6 оболочка за счет заполнения второго энергетического уровня, Cl+1еCl– - ион хлора, получена устойчивая восьми электронная оболочка ls22p63s23р6 за счет заполнения третьего энергетического уровня. Между ионами Na+ и Cl– возникают силы электростатического притяжения, в результате чего образуется соединение. -
Какова схема образования ковалентной полярной связи? Н2О, NH3, H2S, CH3Cl. -
Какова схема образования ковалентной неполярной связи? Такую связь образуют двухатомные молекулы, состоящие из атомов одного химического элемента: H2, Cl2 и др.). -
Какова схема образования металлической связи? -
Какие различают виды кристаллических решеток? томные, ионные, металлические и молекулярные кристаллические решетки.
Тема 4. Растворы. Электролитическая диссоциация
Ключевые понятия:
-
дисперсная система; Дисперсной называется система, в которой одна из фаз – дисперсная фаза в виде мельчайших частиц распределена в другой, называемой дисперсионной средой -
насышенный и ненасыщенный раствор; Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным. -
растворитель; Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем -
растворенное вещество; а компонент, взятый в недостатке - растворенным веществом.
mA, mB – массы компонентов раствора, г,
МА, МВ – молярные массы, г/моль,
V А, V В – количества вещества, моль.
VА= mA/ МА;V В = mB/ МВ.
VA, VB, VAB – объемы растворителя, растворенного вещества и раствора, л (VAB =VA+ VB).
-
массовая доля; отношение массы растворенного вещества к массе раствора, то есть к сумме масс растворенного вещества и растворителя: -
объемная доля; отношение объема растворенного вещества к сумме исходных объемов растворителя и растворенного вещества: -
молярная концентрация; (СВ) – отношение количества растворенного вещества к объему раствора: -
электролиты и неэлектролиты; Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами -
электролитическая диссоциация; Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией. -
реакции ионного обмена.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций - ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
Вопросы для самопроверки:
-
Дайте классификацию дисперсным системам.
| Системы | Диаметр частиц, м | Тип системы |
| Грубо-дисперсные системы | 5·10-7…5·10-5 м | т/ж — взвесь, суспензия (взмученная глина в воде); ж/ж — эмульсия (капли масла в воде). Системы неустойчивы. Частицы видны в оптический микроскоп. |
| Коллоидные системы | 10-9…10-7 м | Частицы в оптическом микроскопе не обнаруживаются. Системы относительно устойчивы, но со временем разрушаются. При получении коллоидных систем затрачивается внешняя энергия. |
| Истинные растворы | < 10-9 м | Молекулярно-дисперсные или ионно-дисперсные системы. Растворы устойчивы, не разрушаются, получаются самопроизвольно. |
-
Как различают растворы в зависимости от агрегатного состояния?
| Дисперсная среда | Дисперсная фаза | ||||
| Газ | Жидкость | Твердое тело | |||
| Газ | - | Аэрозоли — распыленные жидкие вещества (туман, облака) | Аэрозоли — распыленные твердые вещества (дым, пыль) | ||
| Жидкость | Пены | Эмульсии (сливочное масло, маргарин, кремы, мази) | Суспензии (взвеси) и коллоидные растворы (золи) | ||
| Твердое тело | Пемза, пеностекло, пенопласты | Жемчуг, вода в парафине | Окрашенные стекла, многие сплавы | ||
-
Что такое кристаллизация? По мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением - кристаллизацией. -
По каким признакам и как классифицируются растворы? По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. -
Назовите основные способы выражения состава растворов. Массовая доля, Объемная доля, Молярная концентрация
При приготовлении растворов и изучении их свойств используются различные способы выражения состава растворов. Рассмотрим двухкомпонентный раствор, состоящий из растворителя А и растворенного вещества В.
Введем следующие обозначения:
mA, mB – массы компонентов раствора, г,
МА, МВ – молярные массы, г/моль,
-
V А, V В – количества вещества, моль. -
Массовая доля w(B)=m(B)/m(P)
Объемная доля ᵩ(В)= V (B)/V(A)+V(B) или( ᵩ(В)= V (B)/V(A)+V(B))×100%
Молярная доля Ma=
-
Что называется электролитом? Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. -
В чем сущность теории электролитической диссоциации? Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией -
Чем различаются сильные и слабые электролиты? Сильные электролиты при растворении в воде диссоциируют на ионы. Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы и не могут дать большой концентрации ионов в растворе. -
Каким образом диссоциируют в воде кислоты и основания? Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы -
Какие факторы оказывают влияние на степень диссоциации? Природа электролита, природа растворитля, концетрация раствора, температура раствора -
Дайте определение кислотам в свете теории ЭД. Это электролиты , которые при диссоциации образуют катионы водорода и анионы кислотного остатка -
Дайте определение основаниям в свете теории ЭД. Это вещества, диссоциирующие в одном растворе с образованием анионов одного вида-гидрооксид-ионов OH- -
Дайте определение солям в свете теории ЭД. Это электролиты , которые при растворении в воде диссоциируют на катионы металла и анионы кислотного остатка. Средние соли диссоциируют в одну ступень -
Какие реакции называются ионными реакциями (реакциями ионного обмена)? Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями
Тема 5. Классификация неорганических соединений
Вопросы темы:
1. Простые и сложные вещества.
2. Оксиды.
3. Основания.
4. Кислоты.
5. Соли.
Ключевые понятия:
простые и сложные вещества;

-
оксиды; Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород. -
основания; это соединения, которые в воде диссоциируют на ионы металла (аммония в случае гидрата аммиака) и гидроксид-ионы. Никаких других анионов, кроме гидроксид-ионов, основания не образуют. -
кислоты; это соединения, которые в воде диссоциируют на ионы водорода и кислотные остатки – анионы. Никаких других катионов, кроме ионов водорода, кислоты не образуют. -
соли. средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Вопросы для самопроверки:
-
Назовите основные виды неорганических соединений. Всегда содержат углерод -
Какие физические свойства характерны для оксидов?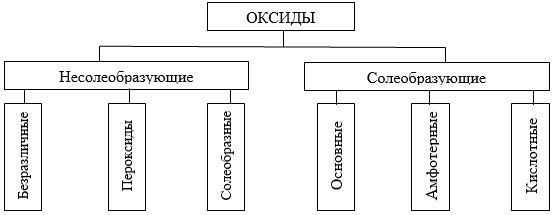
-
Какие химические свойства характерны для основных оксидов? К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований. -
Какие химические свойства характерны для кислотных оксидов? Кислотные оксиды представляют оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например: -
Какие химические свойства характерны для амфотерных оксидов? Обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами: -
Какими способами можно получить оксиды? Разложением соли CaCO3=CaO+CO2 , разложением основания Ca(OH)2=CaO+H2O , разложением кислоты H2SiO3=H2O+SiO2 -
Какие физические свойства имеют основания? Малорастворимые, нерастворимые , растворимые в воде(щелочи) -
Какие химические свойства имеют основания? При взаимодействии оснований с кислотами в эквивалентных количествах образуются соль и вода: Взаимодействие оснований с кислотами называется реакцией нейтрализации. Щелочи взаимодействуют с кислотными оксидами.. Щелочи взаимодействуют с растворами различных солей -
Что такое реакция нейтрализации? Взаимодействие оснований с кислотами называется реакцией нейтрализации. Любая реакция нейтрализации сводится к взаимодействию ионов ОН– и Н+ с образованием малодиссоциированного электролита – воды. -
Какими способами получают основания? при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щелочи -
Какие физические свойства имеют амфотерные гидроксиды? называются такие гидроксиды, которые при диссоциации образуют одновременно и катионы водорода Н+ и гидроксид-ионы ОН–. -
Как амфотерные гидроксиды диссоциируют в кислых и щелочных средах? -
Как амфотерные гидроксиды взаимодействуют с кислотами? Так же как и основания с образованием соли и воды Аl(ОН)3 + 3НСl = АlСl3 + 3Н2О, -
Как амфотерные гидроксиды взаимодействуют со щелочами? Образуют растворимые комплексные соли -
Какие физические свойства имеют кислоты? Кислоты представляют собой жидкости (Н2SO4, НNO3 и др.) или твердые вещества (Н3PO4 и др.). Многие кислоты хорошо растворимы в воде. Растворы их имеют кислый вкус, разъедают растительные и животные ткани, изменяют синий цвет лакмуса на красный

