Файл: Тема Основные химические понятия и законы химии Ключевые понятия атом.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.05.2024
Просмотров: 78
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Тема 3. Химическая связь. Строение вещества
Тема 4. Растворы. Электролитическая диссоциация
Тема 5. Классификация неорганических соединений
1. Простые и сложные вещества.
1. Классификация химических реакций.
2. Окислительно-восстановительные реакции.
3. Скорость химических реакций.
4. Необратимые и обратимые реакции. Химическое равновесие.
Тема 8. Основные понятия органической химии и теория строения
Тема 9. Углеводороды и их природные источники
Тема 10. Кислородсодержащие органические соединения
Как кислоты взаимодействуют с оксидами, основаниями, амфотерными гидроксидами и солями? С точки зрения теории электролитической диссоциации, все общие характерные свойства кислот (кислый вкус, изменение цвета индикатора, взаимодействие с основаниями, основными оксидами, солями) обусловлены ионами водорода Н+, точнее ионами гидроксония Н3O+.
-
Как кислоты взаимодействуют с металлами? Взаимодействие с металлами (с образованием соли и выделением водорода): 2НСl + Fе = FеСl2 + Н2↑ -
Какие способы получения кислот Вы знаете? Взаимодействие водорода с неметаллами, с последующим растворением галогенводорода в воде . Реакция кислотных оксидов с водой. Взаимодействие солей с кислотами -
Какие физические свойства солей Вы знаете? Ионная кристаллическая решетка, высокие температуры плавления, в твердом состоянии плохо проводят электричество, по растворимости выделяют растворимые, малорастворимые, нерастворимые -
Как разделяются соли по растворимости в воде? растворимые, малорастворимые, нерастворимые -
Как взаимодействуют соли с металлами? Происходит реакция замещения:электроны от атомов замещенного- более активного металла переходят к ионам замещаемого- менее активного металла -
Как взаимодействуют соли с кислотами? Протекает реакция обмена , в ходе которой химически более активная кислота вытесняет менее активную -
Как взаимодействуют соли с другими солями? Реакция возможна только если обе соли растворимые и в результате реакции образуется осадок -
Какие способы получения солей Вы знаете? Взаимодействие металла и неметалла, двух оксидов , основных оксидов с кислотами, кислотных оксидов с основаниями, кислот с основаниями ,кислот с солями, оснований с солями, двух солей, металла с кислотами, металла с солями
Тема 6. Химические реакции
Вопросы темы:
1. Классификация химических реакций.
2. Окислительно-восстановительные реакции.
3. Скорость химических реакций.
4. Необратимые и обратимые реакции. Химическое равновесие.
Ключевые понятия:
реакции разложения, соединения, замещения и обмена; Признаки реакции разложения:
в реакции принимает участие только одно исходное вещество, обязательно сложное;
образуется два и более новых веществ, как простых, так и сложных;
как правило, почти все реакции разложения будут эндотермическими, чтобы они протекали, нужна непрерывная подача тепла или использование катализатора.
-
Реакции соединения ― это такие реакции, в результате которых из двух и более исходных веществ образуется одно сложное вещество. Реакции замещения ― это реакции, при которых из исходных простого и сложного веществ образовались новое простое и новое сложное вещества. Реакции обмена ― это реакции, в результате которых два сложных вещества обмениваются своими составными частями, например ионами. -
экзо-и эндотермические реакции; Реакции, протекающие с выделением энергии (отводом во внешнюю среду), называются экзотермическими, протекающие с поглощением энергии (подводом из внешней среды) – эндотермическими. -
тепловой эффект химической реакции; Вся энергия, передаваемая в ходе реакции, условно рассматривается в тепловой форме и называется тепловым эффектом химической реакции (Q). -
термохимические уравнения; Уравнения химических реакций с указание теплового эффекта называются термохимическими уравнениями. -
гомогенные и гетерогенные реакции; Химические реакции также могут быть гомогенными и гетерогенными. Существенно, что гомогенные реакции протекают во всем объеме, занимаемом системой, гетерогенные – только на границе раздела фаз. -
степень окисления; это тот заряд, который атом имеет в ионном соединении или имел бы, если бы общая электронная пара полностью была бы смещена к более электроотрицательному элементу в ковалентном соединении. -
окислительно-восстановительные реакции; Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. -
окислитель; Элемент, принимающий электроны, называется окислителем, в ходе реакции он восстанавливается, его степень окисления уменьшается -
восстановитель; Элемент, отдающий электроны, называется восстановителем, в ходе реакции он окисляется, его степень окисления увеличивается. -
метод электронных уравнений (электронного баланса); Метод электронного баланса базируется на понятии степени окисления. Он носит универсальный характер и применим для всех типов окислительно-восстановительных реакций. -
скорость химической реакции; Под скоростью химической реакции понимается изменение концентрации одного из реагирующих веществ в единицу времени -
правило Вант-Гоффа; Зависимость скорости реакции от температуры определяют в соответствии с так называемым «правилом Вант-Гоффа» В соответствии с этим правилом, повышение температуры на 10° приводит к увеличению скорости в 2–4 раза. -
закон действующих масс; скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. -
катализатор; Катализаторами называют вещества, которые увеличивают скорости химических реакций, но сами при этом не расходуются -
ингибитор; Кроме катализаторов, которые ускоряют реакции, есть вещества, которые замедляют химические реакции, то есть снижают скорость реакции.
химическое равновесие; Не следует, однако полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях: реагенты ↔ продукты. Такие реакции называются обратимыми. Обратимые (и необратимые) химические реакции бывают как гомогенными, так и гетерогенными. Такие реакции протекают до установления в них определенного концентрационного предела, общего для их прямого и обратного направлений, называемого состоянием химического равновесия
-
принцип Ле Шателье. Направление смещения равновесия в каждом конкретном случае можно прогнозировать с помощью принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабляет воздействие на систему.
Вопросы для самопроверки:
-
По каким признакам классифицируются химические реакции?
-
Чему равна степень окисления в любой частице? В простых веществах степень окисления любого элемента равна нулю, в сложных соединениях металлы имеют исключительно положительную степень окисления, неметаллы могут быть как положительными, так и отрицательными. -
Назовите важнейшие восстановители. Важнейшими восстановителями являются: аммиак NН3, гидразин N2H4 и его органические производные, углеводороды, спирты, амины и другие вещества. -
Назовите важнейшие окислители. Важнейшими окислителями являются: азотная кислота НNO3 и ее соли – нитраты, тетраoксид азота N2O4, соли хлорной кислоты НСlО4 – перхлораты, перманганат калия КМnО4 и др. -
В чем смысл метода электронных уравнений (электронного баланса)? Количество электронов, отданных восстановителями равно количеству электронов, принятых окислителями -
От каких факторов зависит скорость химической реакции? От природы реагирующих веществ, концетрации реагентов, площади соприкосновения реагирующих реагентов, температуры , наличия катализатора -
Как скорость химической реакции зависит от температуры? При увеличении температуры молекулы начинают двигаться быстрее, чаще сталкиваться друг с другом. Таким образом ,скорость реакции всегда возрастает при повышении температуры и уменьшается-при понижении -
Какие реакции считаются необратимыми? Реакции при которых взятые вещества нацело превращаются в продукты реакции -
Какие реакции считаются обратимыми? Реакции, одновременно протекающие в двух противоположных направлениях -
В чем суть такого явления как «катализ»? Катализаторами называют вещества, которые увеличивают скорости химических реакций, но сами при этом не расходуются. Явление такого ускорения реакций называется катализом.
Тема 7. Металлы и неметаллы
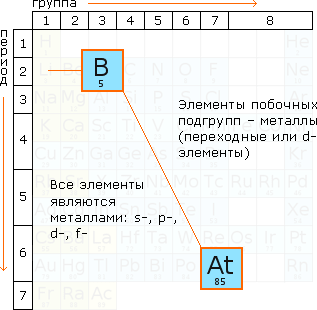
Рис. 10. Положение металлов в Периодической системе
Электрохимический ряд напряжения металлов.
Таблица 5.
Положение неметаллических элементов в периодической системе химических элементов
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | Н | | | | | | He |
| 2-й период | | В | С | N | O | F | Ne |
| 3-й период | | | Si | P | S | Cl | Ar |
| 4-й период | | | | As | Se | Br | Kr |
| 5-й период | | | | | Te | I | Xe |
| 6-й период | | | | | | At | Rn |
Ключевые понятия:
-
металл; К металлам относят простые вещества, образованные атомами элементов, имеющих небольшое число (от 1 до 4) электронов на внешнем энергетическом уровне
металлическая связь; ― это связь между положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов.

