ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 24
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Трансфосфорилирование («путь спасения») - синтез АТФ из двух молекул АДФ: АДФ + АДФ Аденилаткиназа -- АТФ + АМФ. Подобный механизм включается в энергооборот, когда в клетке исчерпаны возможности первых двух. В результате трансфосфорилирования повышается концентрация АМФ, что служит аллостерическим сигналом к повышению скорости катаболических реакций, приводящих, в свою очередь, к росту генерации АТФ
Окислительное декарбоксилирование пирувата – это процесс образование из ПВК ацетил КоА, с образованием углекислого газа и NADH+H, с участием HS-KoA под действием ПДГК. Этот процесс протекает в матриксе митохондрий. ПДГК (мультиферментный пирувтдегидрогеназный комплекс) состоит из трех энзимов. Их простетические группы представлены активными формами витаминов B1 (тиамин TPF) и B2 (рибофлавин FAD), витамин PP NAD), липоевой кислоты (витаминоподобное соединение), SH-KoA – активная форма пантотеновой кислоты. . Энергия, выделяемая в результате этой реакции равна 33.5(не точно, но возможно выделяется 2 АТФ) кДж. Регуляция осуществляется тремя механизмами: 1) Ингибирование продуктами: ацетил-КоА подавляет активность трансацетилазы, а НАДН + Н+ - служит ингибитором дигидролипоилдегидрогеназы. И наоборот. 2) Регуляция нуклеотидами, являющимися аллостерическими эффекторами. Для Е1, в качестве ингибитора используется ГТФ, а АМФ является активатором.3) Регуляция путем ковалентной модификации через реакцию фосфори-лирования. специфический остаток серина фермента Е3 фосфорилируется с помощью АТФ. В результате комплекс ингибируется. И наоборот, дефосфорилирование, осуществляемое специфическими фосфатазами, активирует пируватдегидрогеназный комплекс.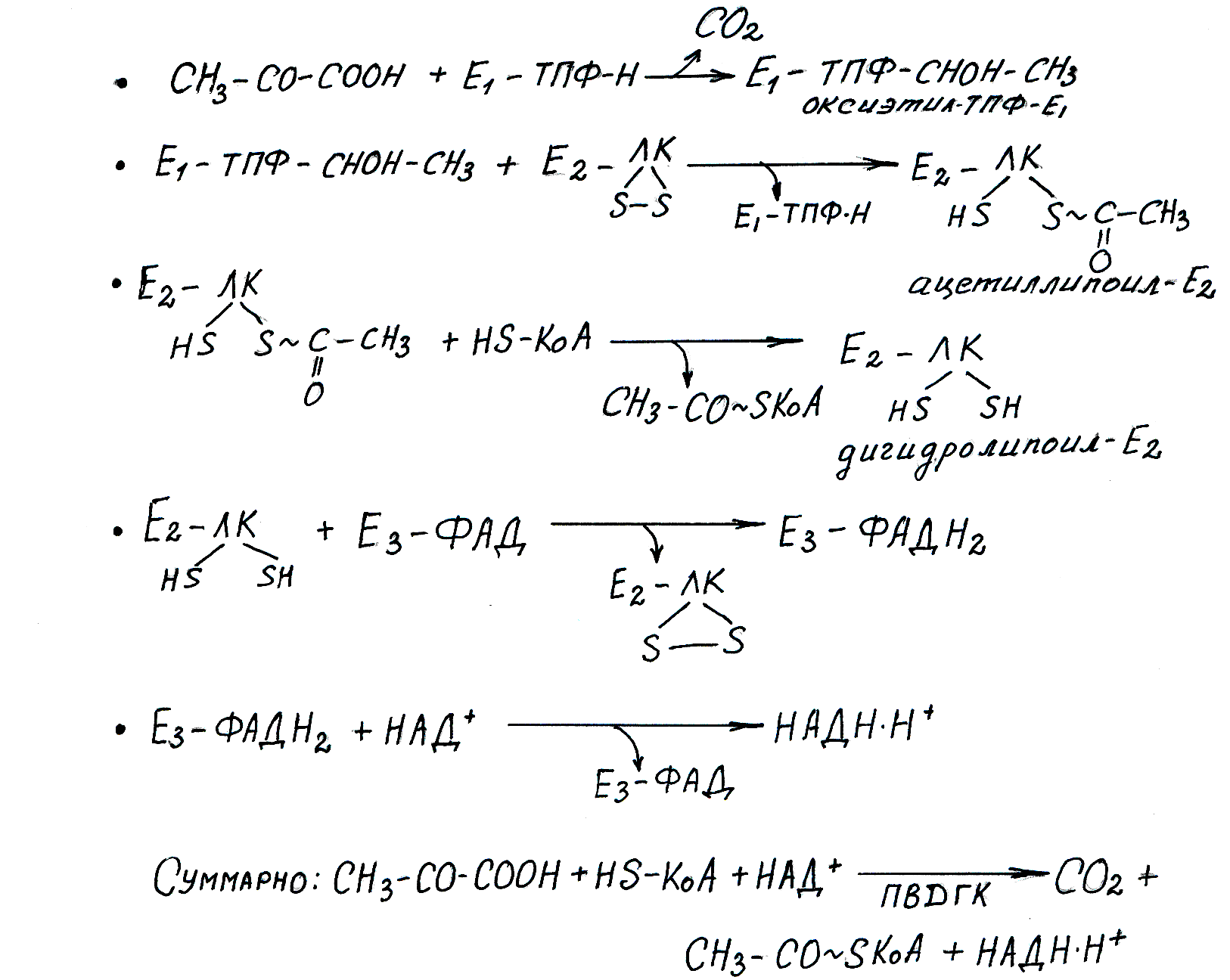
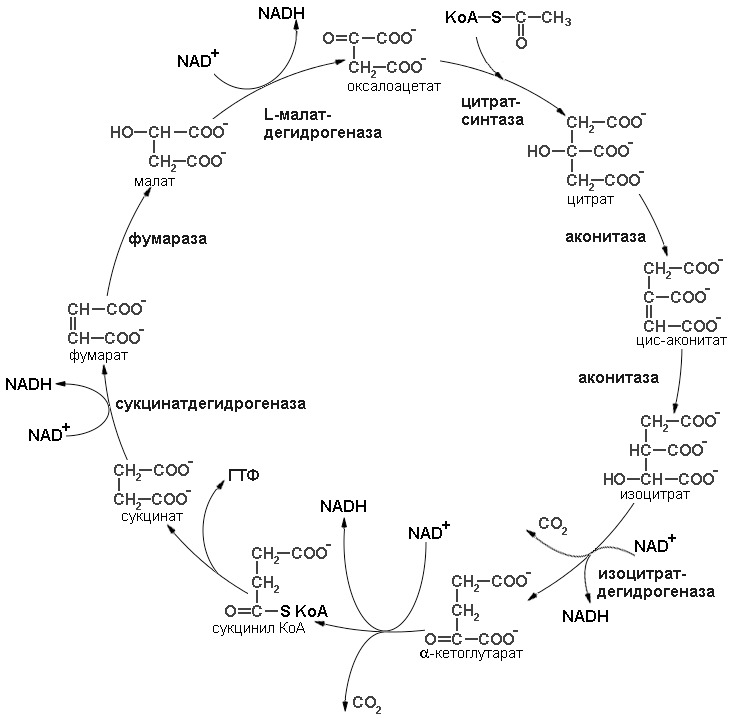
Цикл лимонной кислоты (цикл трикарбоновых кислот - ЦТК, цикл Кребса) представляет собой серию реакций, протекающих в митохондриях, в ходе которых осуществляется катаболизм ацетильных групп и высвобождение восстановительных эквивалентов; при окислении последних поставляется свободная энергия топливных ресурсов тканей(АТФ). Биологическая роль ЦТК: Является конечным путем распада У, Б, Л. Которые превращаются в ацетил – KoA, либо метаболитов этого процесса. 2) ЦТК – основной источник восстановительных эквивалентов, запускающих ЭТЦ и окис.фосфорилирование. – источник АТФ. 3)Является основным циклом организма, источник продуктов для анаболитических процессов. (Например, ОА – идет в ГНГ). Регуляция осуществляется: 1) Ингибирование продуктами: Чем больше Ацетил КоА, тем выше скорость ЦТК (и наоборот, чем выше HS-KoA тем медленнее будет протекать). 2) Если больше кол-во окисленный форм NAD и FAD, то процесс протекает быстрее и наоборот. 3) Если АТФ много, то замедляется, если мало, то увеличивается. (Является аллостерическим методом регуляции – АДФ связывается в аллостерическом центре, тем самым меняют конформацию ферментов к субстрату). Энергетическая ценность: каждый цикл обеспечивает синтез 12 молекул АТФ (с облигатным использованием биологического окисления и сопряженного с ним окислительного фосфорилирования).(NADH – 3 ATF, FAD – 2 ATF, ГТФ – субстратное фосфорилирование)
УГЛЕВОДНЫЙ ОБМЕН
Классификация: Простые углеводы (не способные к гидролизу)(моносахариды) и сложные (олиго – полисахариды) (Способны к гидролизу) 2) В зависимости от кол-ва атомов углерода (Пример, пентозы, гексосы, гептозы). Важнейшие представители каждого класса: 1) Гексозы: а) Глюкоза – основная функция, высвобождение энергии при распаде, единственное соединение, способное служить источником энергии в условиях дефицита кислорода. Также из глюкозы могут синтезироваться различные соединения (УДФГК) б) галактоза – обязательный компонент гликолипидов и гликопротеинов – структура клеточных и органоидных мембран. 2)Пентозы: особая роль принадлежит рибозе и дезоксирибозе. Находятся в составе ДНК и РНК, что обеспечивает нормальное выполнение репродуктивной функции и непрерывный синтез белков. ДНК и РНК – это биополимеры, мономеры которых также могут обеспечивать жизнедеятельность тканей (АТФ). 3)
Дисахариды: лактоза – синтезируется в молочных железах – жизненно важный компонент для питания младенцев. 4) Олигосахариды – служат звеньями других сложных веществ неуглеводной природы, входят в состав гликопротеинов или гликолипидов. 5) Полисахариды: а) Гомополисахариды: Гликоген, крахмал (а – глюкоза) и клетчатка (b – глюкоза). б) Гетерополисахариды: Помимо углеводной части, есть не углеводная. Например: гликозамингликаны (ГАГ) – гиалуронавая кислота, дерматансульфат, кератосульфат. Функция: Фундамент различных соединительных тканей, также формируют защитную оболочку многих органов, гликокаликс. Функции углеводов: Энергетическая, защитно-механическая (ГАГ – смазка суставов), опорно-структурная, гидроосмотическая (ГАГ способны удерживать воду).
Значительное количество фруктозы, образующееся при расщеплении сахарозы, превращается в глюкозу уже в клетках кишечника. Часть фруктозы поступает в печень. Метаболизм фруктозы в клетке начинается с реакции фосфорилирования: 1.Фруктокиназа(АТФ: фруктоза-1-фосфотрансфераза) фосфорилирует только фруктозу, имеет к ней высокое сродство. Содержится в печени, почках, кишечнике. Инсулин не влияет на ее активность 2. Альдолаза В(фруктозо: ГА-лиаза) есть в печени, расщепляет фруктозо-1ф (фруктозо-1,6ф) до глицеринового альдегида (ГА) и диоксиацетонфосфата (ДАФ). ДАФ и ГА, полученные из фруктозы, включаются в печени главным образом в глюконеогенез. Причиной нарушения метаболизма фруктозы является дефект ферментов. Наследственная непереносимость фруктозы частая патология, возникает при генетически дефекте альдолазы B. Доброкачественная фруктозурия связана с недостаточностью фруктокиназы, клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой. Метаболизм галактозы Галактоза образуется в кишечнике в результате гидролиза лактозы. Превращение галактозы в глюкозу происходит в печени. Галактокиназа (АТФ: галактозо-1-фосфотрансфераза) фосфорилирует галактозу. Галактозо-1ф-уридилтрансфераза далее под действием этого фермента, к галактозе присоединяется остаток УДФ и образуется галактоза УДФ – далее под действием фермента эпимеразы –
происходит превращение УДФ галактозы в УДФ глюкозы и снова под действием УДФ трансферазы происходит отщепление УДФ и образование глюкозы 1 ф. Галактоземия обусловленна наследственным дефектом любого из трёх ферментов, включающих галактозу в метаболизм глюкозы. Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилтрансферазы (ГАЛТ). В крови, моче и тканях повышается концентрация галактозы и галактозо-1-ф. Метаболизм фруктозы и галактозы включает пути использования их для синтеза других веществ (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении организма. (OH группа слева – D изомер, справа – L)
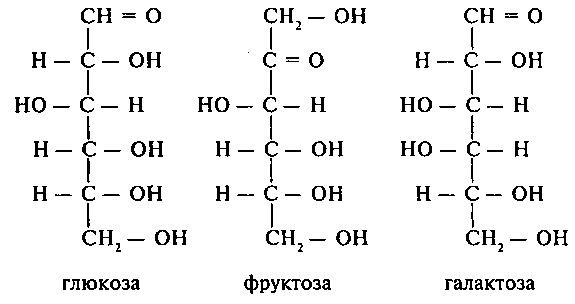
Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Особенности переваривания в тонком кишечнике. Роль клетчатки. Варианты непереносимости дисахаридов. Механизм развития диспептических расстройств кишечника.
Первые пищевые углеводы встречает α-амилазаслюны, которая начинает распад крахмала и гликогена, действуя на α-1,4-гликозидные связи (оптимум рН 7,1-7,2). Процесс происходит короткое время, после они попадают в желудок, где процесс пищеварения на время приостанавливается (И под действием hcl – инактивируется амилаза). Когда пища попадает в тонкий кишечник, то процесс возобновляется под действием поджелудочной α-амилазы и олигогликозидазы (разрушающую α-1,6-связи в точках ветвления гомополисахаридов) Укорочение цепей углеводов завершается в ворсинках тощей кишки (пристеночное пищеварение), где находятся сложные мультиэнзимные системы:сахаразо-изомальтазный комплекс (рабочее название сахараза) гидролизует α-1,2-, α-1,4-, α-1,6-гликозидные связи в сахарозе, мальтозе, мальтотриозе, изомальтозе; гликоамилазный комплекс расщепляет α-1,4-гликозидные связи в олигосахаридах; β-гликозидазный комплекс (рабочее название лактаза) – разрушает β-1,4-гликозидные связи между галактозой и глюкозой (лактозу). Все высвобождающиеся из сложных углеводов пищи моносахариды всасываются ворсинками энтероцитов путем облегченной диффузии. Глюкоза и галактоза особенно важны для жизнедеятельности организма, поэтому их поступление в клетки продолжается за счет активного транспорта с помощью Na+, K+-зависимой АТФазы и транслоказ. Далее по воротной вене поступает в печень, где сортируется и используется на различные нужды организма: В печени на синтез гликогена, в кровь для питания тканей, или синтез ТАГ и холестерина. Клечатка: ее волокны касаясь стенок кишечника при продвижении, они раздражают последние, что стимулирует перистальтику, а также препятствует всасыванию различных токсичных веществ, избытка глюкозы, ХС. Кроме того этот полисахарид опосредованно активирует выработку пищеварительных (желудочного, панкреатического, кишечного) соков и жёлчи. Выделяют непереносимость лактозы, мальтозы и сахарозы, связанно это с дефектом ферментативных комплексов отвечающих за их распад, или ферментов их мономеров. Диспепсия – это патологическое состояние, хар-ся нарушением работы желудка. Механизм развития диспепсии: Неправильное питание - - не достаточная обработка пищи на уровне желудка и начального отдела тонкой кишки - - поступление неподготовленного химуса с избыточным содержанием нерасщепленных бжу - - расстройство пищеварения.
-
Окислительное декарбоксилирование пирувата, определение, локализация, схема процесса, строение пируватдегидрогеназного комплекса, участие витаминов в его работе, энергетическая ценность, регуляция. Биологическое значение процесса. Связь с тканевым дыханием и окислительным фосфорилированием.
Окислительное декарбоксилирование пирувата – это процесс образование из ПВК ацетил КоА, с образованием углекислого газа и NADH+H, с участием HS-KoA под действием ПДГК. Этот процесс протекает в матриксе митохондрий. ПДГК (мультиферментный пирувтдегидрогеназный комплекс) состоит из трех энзимов. Их простетические группы представлены активными формами витаминов B1 (тиамин TPF) и B2 (рибофлавин FAD), витамин PP NAD), липоевой кислоты (витаминоподобное соединение), SH-KoA – активная форма пантотеновой кислоты. . Энергия, выделяемая в результате этой реакции равна 33.5(не точно, но возможно выделяется 2 АТФ) кДж. Регуляция осуществляется тремя механизмами: 1) Ингибирование продуктами: ацетил-КоА подавляет активность трансацетилазы, а НАДН + Н+ - служит ингибитором дигидролипоилдегидрогеназы. И наоборот. 2) Регуляция нуклеотидами, являющимися аллостерическими эффекторами. Для Е1, в качестве ингибитора используется ГТФ, а АМФ является активатором.3) Регуляция путем ковалентной модификации через реакцию фосфори-лирования. специфический остаток серина фермента Е3 фосфорилируется с помощью АТФ. В результате комплекс ингибируется. И наоборот, дефосфорилирование, осуществляемое специфическими фосфатазами, активирует пируватдегидрогеназный комплекс.

-
Цикл трикарбоновых кислот, определение, локализация, схема процесса, биологическая роль. Связь с процессами биологического окисления и окислительного фосфорилирования. Энергетическая ценность. Регуляция.
Цикл лимонной кислоты (цикл трикарбоновых кислот - ЦТК, цикл Кребса) представляет собой серию реакций, протекающих в митохондриях, в ходе которых осуществляется катаболизм ацетильных групп и высвобождение восстановительных эквивалентов; при окислении последних поставляется свободная энергия топливных ресурсов тканей(АТФ). Биологическая роль ЦТК: Является конечным путем распада У, Б, Л. Которые превращаются в ацетил – KoA, либо метаболитов этого процесса. 2) ЦТК – основной источник восстановительных эквивалентов, запускающих ЭТЦ и окис.фосфорилирование. – источник АТФ. 3)Является основным циклом организма, источник продуктов для анаболитических процессов. (Например, ОА – идет в ГНГ). Регуляция осуществляется: 1) Ингибирование продуктами: Чем больше Ацетил КоА, тем выше скорость ЦТК (и наоборот, чем выше HS-KoA тем медленнее будет протекать). 2) Если больше кол-во окисленный форм NAD и FAD, то процесс протекает быстрее и наоборот. 3) Если АТФ много, то замедляется, если мало, то увеличивается. (Является аллостерическим методом регуляции – АДФ связывается в аллостерическом центре, тем самым меняют конформацию ферментов к субстрату). Энергетическая ценность: каждый цикл обеспечивает синтез 12 молекул АТФ (с облигатным использованием биологического окисления и сопряженного с ним окислительного фосфорилирования).(NADH – 3 ATF, FAD – 2 ATF, ГТФ – субстратное фосфорилирование)

УГЛЕВОДНЫЙ ОБМЕН
-
Основные углеводы организма человека, особенности их строения и классификация. Биологическая роль углеводов (привести примеры).
Классификация: Простые углеводы (не способные к гидролизу)(моносахариды) и сложные (олиго – полисахариды) (Способны к гидролизу) 2) В зависимости от кол-ва атомов углерода (Пример, пентозы, гексосы, гептозы). Важнейшие представители каждого класса: 1) Гексозы: а) Глюкоза – основная функция, высвобождение энергии при распаде, единственное соединение, способное служить источником энергии в условиях дефицита кислорода. Также из глюкозы могут синтезироваться различные соединения (УДФГК) б) галактоза – обязательный компонент гликолипидов и гликопротеинов – структура клеточных и органоидных мембран. 2)Пентозы: особая роль принадлежит рибозе и дезоксирибозе. Находятся в составе ДНК и РНК, что обеспечивает нормальное выполнение репродуктивной функции и непрерывный синтез белков. ДНК и РНК – это биополимеры, мономеры которых также могут обеспечивать жизнедеятельность тканей (АТФ). 3)
Дисахариды: лактоза – синтезируется в молочных железах – жизненно важный компонент для питания младенцев. 4) Олигосахариды – служат звеньями других сложных веществ неуглеводной природы, входят в состав гликопротеинов или гликолипидов. 5) Полисахариды: а) Гомополисахариды: Гликоген, крахмал (а – глюкоза) и клетчатка (b – глюкоза). б) Гетерополисахариды: Помимо углеводной части, есть не углеводная. Например: гликозамингликаны (ГАГ) – гиалуронавая кислота, дерматансульфат, кератосульфат. Функция: Фундамент различных соединительных тканей, также формируют защитную оболочку многих органов, гликокаликс. Функции углеводов: Энергетическая, защитно-механическая (ГАГ – смазка суставов), опорно-структурная, гидроосмотическая (ГАГ способны удерживать воду).
-
Моносахариды (особенности строения, классификация, отдельные представители и их биологическая роль). Особенности обмена фруктозы и галактозы. Патология обмена моносахаридов [галактоземия и фруктозурия]: причины, изменения биохимических показателей крови, мочи.
Значительное количество фруктозы, образующееся при расщеплении сахарозы, превращается в глюкозу уже в клетках кишечника. Часть фруктозы поступает в печень. Метаболизм фруктозы в клетке начинается с реакции фосфорилирования: 1.Фруктокиназа(АТФ: фруктоза-1-фосфотрансфераза) фосфорилирует только фруктозу, имеет к ней высокое сродство. Содержится в печени, почках, кишечнике. Инсулин не влияет на ее активность 2. Альдолаза В(фруктозо: ГА-лиаза) есть в печени, расщепляет фруктозо-1ф (фруктозо-1,6ф) до глицеринового альдегида (ГА) и диоксиацетонфосфата (ДАФ). ДАФ и ГА, полученные из фруктозы, включаются в печени главным образом в глюконеогенез. Причиной нарушения метаболизма фруктозы является дефект ферментов. Наследственная непереносимость фруктозы частая патология, возникает при генетически дефекте альдолазы B. Доброкачественная фруктозурия связана с недостаточностью фруктокиназы, клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой. Метаболизм галактозы Галактоза образуется в кишечнике в результате гидролиза лактозы. Превращение галактозы в глюкозу происходит в печени. Галактокиназа (АТФ: галактозо-1-фосфотрансфераза) фосфорилирует галактозу. Галактозо-1ф-уридилтрансфераза далее под действием этого фермента, к галактозе присоединяется остаток УДФ и образуется галактоза УДФ – далее под действием фермента эпимеразы –
происходит превращение УДФ галактозы в УДФ глюкозы и снова под действием УДФ трансферазы происходит отщепление УДФ и образование глюкозы 1 ф. Галактоземия обусловленна наследственным дефектом любого из трёх ферментов, включающих галактозу в метаболизм глюкозы. Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилтрансферазы (ГАЛТ). В крови, моче и тканях повышается концентрация галактозы и галактозо-1-ф. Метаболизм фруктозы и галактозы включает пути использования их для синтеза других веществ (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении организма. (OH группа слева – D изомер, справа – L)
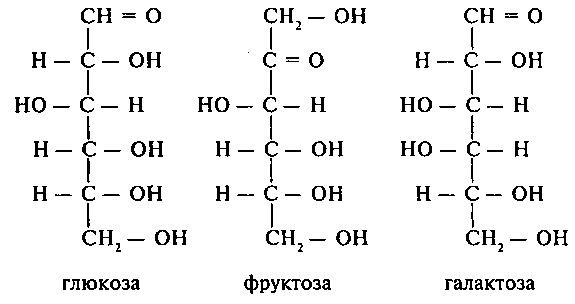
- 1 2 3 4 5 6
Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Особенности переваривания в тонком кишечнике. Роль клетчатки. Варианты непереносимости дисахаридов. Механизм развития диспептических расстройств кишечника.
Первые пищевые углеводы встречает α-амилазаслюны, которая начинает распад крахмала и гликогена, действуя на α-1,4-гликозидные связи (оптимум рН 7,1-7,2). Процесс происходит короткое время, после они попадают в желудок, где процесс пищеварения на время приостанавливается (И под действием hcl – инактивируется амилаза). Когда пища попадает в тонкий кишечник, то процесс возобновляется под действием поджелудочной α-амилазы и олигогликозидазы (разрушающую α-1,6-связи в точках ветвления гомополисахаридов) Укорочение цепей углеводов завершается в ворсинках тощей кишки (пристеночное пищеварение), где находятся сложные мультиэнзимные системы:сахаразо-изомальтазный комплекс (рабочее название сахараза) гидролизует α-1,2-, α-1,4-, α-1,6-гликозидные связи в сахарозе, мальтозе, мальтотриозе, изомальтозе; гликоамилазный комплекс расщепляет α-1,4-гликозидные связи в олигосахаридах; β-гликозидазный комплекс (рабочее название лактаза) – разрушает β-1,4-гликозидные связи между галактозой и глюкозой (лактозу). Все высвобождающиеся из сложных углеводов пищи моносахариды всасываются ворсинками энтероцитов путем облегченной диффузии. Глюкоза и галактоза особенно важны для жизнедеятельности организма, поэтому их поступление в клетки продолжается за счет активного транспорта с помощью Na+, K+-зависимой АТФазы и транслоказ. Далее по воротной вене поступает в печень, где сортируется и используется на различные нужды организма: В печени на синтез гликогена, в кровь для питания тканей, или синтез ТАГ и холестерина. Клечатка: ее волокны касаясь стенок кишечника при продвижении, они раздражают последние, что стимулирует перистальтику, а также препятствует всасыванию различных токсичных веществ, избытка глюкозы, ХС. Кроме того этот полисахарид опосредованно активирует выработку пищеварительных (желудочного, панкреатического, кишечного) соков и жёлчи. Выделяют непереносимость лактозы, мальтозы и сахарозы, связанно это с дефектом ферментативных комплексов отвечающих за их распад, или ферментов их мономеров. Диспепсия – это патологическое состояние, хар-ся нарушением работы желудка. Механизм развития диспепсии: Неправильное питание - - не достаточная обработка пищи на уровне желудка и начального отдела тонкой кишки - - поступление неподготовленного химуса с избыточным содержанием нерасщепленных бжу - - расстройство пищеварения.


