Файл: Обычные Bacillus subtilis 0,70,8x23 Escherichia coli 0,31х16 Staphylococcus aureus 0,51,0 Thiobacillus thioparus 0,5х13 Rickettsia prowazeki 0,30,6x0,82 Мелкие.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.04.2024
Просмотров: 171
Скачиваний: 8
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Линейные лабораторные животные очень чувствительны к неблагоприятным факторам окружающей среды, поэтому условия содержания их должны быть лучше, чем нелинейных животных.
Выбор вида, линии, возраста и пола животных диктуется целями исследований. Отобранных животных тщательно осматривают, больных выбраковывают. Перед проведением эксперимента все животные должны быть выдержаны в виварии на 2-х недельном карантине. Животные, взятые в эксперимент, должны быть здоровы, чувствительны к предполагаемому возбудителю, однородны по породе, линии, массе, возрасту, полу, упитанности, промаркированы.
Методы заражения лабораторных животных.
Применяют следующие методы заражения животных: накожный, внутрикожный, подкожный, внутримышечный, внутривенный, пероральный, интраназальный, внутриполостной (в брюшную полость, в грудную полость, в переднюю камеру глаза), внутриорганный (в мозг, в лёгкие).
Способ заражения зависит от вида материала, вида животного, тропизма микроба.
Материал вводят с соблюдением правил асептики. При болезненных вмешательствах предварительно проводят анестезию.
Накожный метод. На кожу спины или живота, освобождённую от шерсти, наносят царапины скарификационной иглой. Материал берут стеклянной палочкой и втирают досуха.
Внутрикожный метод. Местом введения обычно выбирают кожу спины или живота. Шерсть на этом месте за два дня до опыта удаляют депилятором. Используют очень тонкие и острые иглы с пологим скосом. Иглу вводят в кожу под очень острым углом скосом вверх. Инъецируют до 0,1 мл раствора. Образовавшееся вздутие («лимонная корочка») не исчезает 3–5 минут.
Подкожный метод. Иглу шприца вводят в основание кожной складки предполагаемого места инъекции. После прокола кожи направление иглы меняют и медленно вводят жидкость – мышам не более 1,0 мл, морским свинкам и крысам –1,5 мл, кроликам –3,0 мл, место введения обрабатывают антисептиком. Следят за тем, чтобы введенный материал не вытекал наружу.
Внутримышечный метод. Лучшим местом введения считается участок с развитым мышечным слоем в области верхней трети задней лапы животного. Острие иглы направляют почти перпендикулярно участку.
Внутривенный метод.
Инъекцию производят в краевую вену уха кроликов, яремную вену морских свинок, хвостовую вену крыс или мышей. Обрабатывают кожу над веной. Для лучшего наполнения вены ее пережимают ниже будущего введения или кожу обогревают теплой (550С) водой. Материал вводят медленно.
Пероральный метод. Объём жидкости, вводимой перорально, зависит от вида и возраста животного. Кроликов и морских свинок пеленают и располагают в положении, близком к вертикальному. Материал вводят принудительно с помощью тонкого эластичного зонда. Процесс введения зонда требует навыков. Перед введением зонда животному вставляют роторасширитель с отверстием в середине. Продвижение зонда по пищеводу обычно не вызывает затруднений, если его конец смазан вазелином, а у животного вызывают глотательные движения закапыванием в рот нескольких капель воды. Через воронку или шприц жидкость вливают в желудок.
Крыс или мышей помощник фиксирует в вертикальном положении, рот открывают браншами пинцета. Жидкость можно вводить двумя способами: а) шприцем со специальной изогнутой иглой, конец которой утолщен в виде шарика с боковым отверстием; б) шприцем с обычной иглой, на которую насажен тонкий эластичный зонд.
Внутрибрюшинный метод. Инъекцию производят в задней трети живота. Место введения обрабатывают антисептиком до и после инъекции. Животное располагают вниз головой или в наклонном положении. Несколько отступив от средней линии, брюшную стенку прокалывают, вводят иглу под тупым углом к стенке. Игла должна быть с притупленным концом во избежание повреждения внутренних органов.
Наблюдение за животным. В период наблюдения за животным должен быть обеспечен надлежащий уход; методика наблюдения зависит от ожидаемого эффекта:
а) при определении вирулентности, токсигенности, токсичности наблюдают появление инфильтратов или учитывают гибель животного;
б) при этиологической диагностике наблюдают за возникновением признаков заболевания; берут материал для бактериологического и серологического исследования, соблюдая правила асептики; ставят аллергические пробы.
Гибель (умерщвление) животного и вскрытие трупа.
Между смертью и вскрытием трупа животного должно проходить как можно меньше времени, так как кишечная флора даже при температуре холодильника проникает в ткани, кровь, органы через 20–27 часов. Более целесообразно умерщвлять животное в агональный период.
Ход вскрытия зависит от задач исследования: изучают патологоанатомическую и патоморфологическую картину, делают посев органов для выявления обсеменённости и выделения чистой культуры, из внутренних органов готовят мазки-отпечатки.
Все этапы работы с лабораторными животными регистрируют в специальном журнале с графами:
- вид лабораторного животного
- цель заражения
- время заражения
- материал, примененный для заражения
- изменение поведенческих реакций животного после заражения
- время гибели (умерщвления) животного
- изменения, обнаруженные при вскрытии
- материал, взятый для посева
- свойства микроорганизма
- вид микроорганизма.
После вскрытия труп животного сжигают, автоклавируют или кипятят 1-2 часа в растворе фенола; инструменты дезинфицируют, очищают, затем стерилизуют. Трупы животных, павших от особо опасных инфекций, вскрывают в специальных помещениях с соблюдением особых мер предосторожности.
Идентификация выделенной культуры и заключение по результатам исследования.
Достоинства метода:
- относительно высокая чувствительность;
- высокая специфичность;
- ранний метод исследования.
Недостатки метода:
- длительность;
- не всегда доступен;
- опасность инфицирования;
- дорогостоящий.
Агглютинация - склеивание антигеннесущих корпускулярных частиц молекулами специфических антител в присутствии электролитов, которое заканчивается образованием видимых невооруженным глазом хлопьев или осадка (агглютината). Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевидный осадок, безжгутиковые и бескапсульные - мелкозернистый, капсульные - тяжистый. Различают агглютинацию прямую, при которой во взаимодействии со специфическими антителами непосредственно участвуют собственные антигены бактериальной или любой другой клетки, например, эритроцитов; и пассивную, при которой бактериальные клетки или эритроциты являются носителями не собственных, а сорбированных на них чужих антигенов (или антител) для выявления специфических к ним антител (или антигенов).
Реакция агглютинации протекает в две фазы: вначале происходит специфическое взаимодействие активного центра антител с детерминантом антигена, эта стадия может происходить в отсутствие электролитов и не сопровождается видимыми изменениями реагирующей системы. Для второй стадии необходимо наличие электролитов, которые снижают заряд комплексов антиген +антитело и ускоряют процесс их склеивания. Эта фаза заканчивается образованием агглютината.
Реакции агглютинации ставят либо на стеклянных пластинках, либо в стерильных агглютинационных пробирках. Реакции агглютинации на стекле обычно применяют в качестве ускоренного метода обнаружения специфических антител в сыворотке больного или для серологической идентификации возбудителя. В последнем случае обычно используют очищенные (адсорбированные) диагностические сыворотки, содержащие монорецепторные антитела.

Рис. РА на стекле.
Развернутая реакция агглютинации в пробирках позволяет определить количественное содержание антител в сыворотке и при необходимости зарегистрировать факт нарастания титра антител, что имеет диагностическое значение. Для постановки реакции в пробирки вносят разведенную 0,85 процентным раствором хлорида натрия сыворотку и равный объем (обычно 0,5 мл) суспензии стандартного диагностикума (или исследуемой культуры), содержащей в 1 мл 1 млрд бактерий. За титр сыворотки принимают последнее разведение сыворотки, в которой еще наблюдается четкая агглютинация. Учет результатов реакции производят окончательно через 20-24 ч по двум признакам: наличию и величине осадка и степени прозрачности надосадочной жидкости. Оценку осуществляют по четырехкрестной системе. Положительной считается как минимум 3-крестовая реакция. Реакция обязательно сопровождается контролем сыворотки и антигена.
РА для серодиагностики широко применяют при брюшном тифе, паратифах (реакция Видаля), бруцеллезе (реакция Райта) и др. Антителом при этом является сыворотка больного, а антигеном - известный микроб.
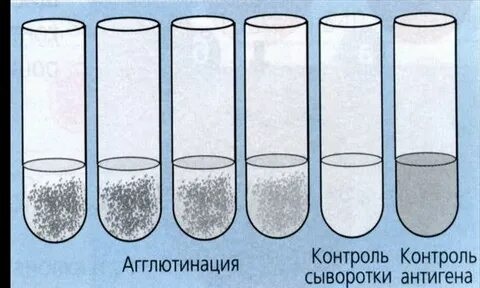
Рис. РА Райта
Оценка результатов по четырехкрестной системе:
++++ – жидкость в пробирке прозрачна, очень большой осадок в виде зонтика – полная агглютинация;
+++ – жидкость почти прозрачна, осадок значительный – почти полная агглютинация;
++ – жидкость непрозрачная, осадок небольшой – слабая агглютинация;
+ – жидкость непрозрачная, осадок незначительный, едва заметный невооруженным взглядом; при взбалтывании можно увидеть хлопья или зернистость в лупу или агглитиноскоп – отмечаются следы агглютинации
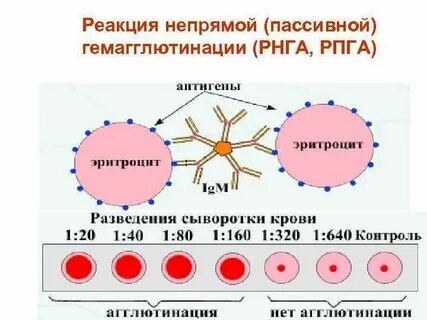
Реакцию пассивной гемагглютинации ставят в специальных полистироловых пластинках с луночками, имеющими полусферическое дно. При использовании ее для серологической диагностики в этих луночках готовят двукратные разведения в физиологическом растворе исследуемой сыворотки, и затем добавляют к ней в качестве диагностикума взвесь сенсибилизированных эритроцитов. Учет результатов проводят через 2 часа инкубации при 37 градусов по Цельсию по четырехкрестной системе. При положительной реакции агглютинировавшиеся эритроциты оседают на дно луночки и равномерно покрывают его в виде перевернутого зонтика. При отрицательной реакции эритроциты тоже оседают, жидкость становится прозрачной, осадок выглядит в виде маленького «диска» в центре луночки. Титром сыворотки в РПГА считается ее последнее разведение, которое еще дает ярко выраженную гемагглютинацию без значительных признаков наличия «диска».
РПГА может применяться в качестве обнаружения непосредственно в исследуемом материале неизвестных бактерий, вирусов, токсинов. При таком варианте постановки РПГА в роли известного компонента реакции используют эритроциты, адсорбировавшие известные по своей специфичности антитела - антительный эритроцитарный диагностикум. Если исследуемый материал содержит достаточное количество известного антигена, РПГА будет положительна.
В основе реакции лежит способность специфических антител образовывать иммунные комплексы с клетками, в том числе с эритроцитами, бактериями, что приводит к активации системы комплемента по классическому пути и лизису клеток. Из реакций иммунного лизиса чаще других применяется реакция гемолиза и редко - реакция бактериолиза (главным образом, при дифференциации холерных и холероподобных вибрионов).
РЕАКЦИЯ ГЕМОЛИЗА: литическое действие иммунной сыворотки в присутствии комплемента особенно четко проявляется в отношении эритроцитов. Если кролика иммунизировать эритроцитами барана, кроличья сыворотка приобретает специфическую гемолитическую активность, т.е. способность вызывать гемолиз эритроцитов, использованных для иммунизации. Этот эффект абсолютно зависим от иммунизации. Таким образом, наличие или отсутствие активного комплемента в гемолитической сыворотке очень четко выявляется по результатам ее взаимодействия с гомологичными эритроцитами: при наличии комплемента - гемолиз, образование «лаковой крови»; при его отсутствии - гемагглютинация, эритроциты выпадают на дно пробирки, образуя осадок в виде зонтика, жидкость бесцветна.


