Файл: Обычные Bacillus subtilis 0,70,8x23 Escherichia coli 0,31х16 Staphylococcus aureus 0,51,0 Thiobacillus thioparus 0,5х13 Rickettsia prowazeki 0,30,6x0,82 Мелкие.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.04.2024
Просмотров: 175
Скачиваний: 8
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Mycobacterium tuberculosis
Микробиологическую диагностику туберкулеза проводят микроскопическим, бактериологическим, биологическим, серологическим, аллергологическим методами.
Микроскопический метод. Материалом для микроскопического исследования чаще бывает мокрота. Предпочтение отдается утренней порции. При недостаточном количестве ее собирают в течение суток. Более ценным материалом при отсутствии мокроты является промывные воды бронхов.
Мокроту выливают в чашку Петри, выбирают желто-зеленые гнойные комочки, переносят на предметное стекло, готовят мазок и окрашивают по Цилю-Нильсену. Во время микроскопии мазка на синем фоне (посторонний материал: лейкоциты, слизь, другие микробы окрашиваются в синий цвет) видны окрашенные фуксином в рубиново-красный цвет микобактерии в виде тонких, коротких или длинных, прямых или слегка изогнутых палочек, иногда расположенных под углом, часто кучками или небольшими скоплениями. Этот способ окрашивания позволяет выявить кислотоустойчивые микроорганизмы. Положительное заключение делают при обнаружении микобактерий туберкулеза в препарате после пересмотра не менее 100 полей зрения. Гной исследуют как и мокроту. При исследовании мочи, промывных вод бронхов, пунктатов и т.д. материал центрифугируют и готовят мазок из осадка. Препарат из осадка мочи обесцвечивают не только кислотой, но и спиртом, для дифференциации от M. Smegmatis, которые могут находиться в моче здоровых людей.
Спинномозговую жидкость отстаивают в холодильнике и готовят мазок из нежной пленки фибрина. Необходимо учитывать, что содержание микобактерий в исследуемом материале может быть незначительным выделение их эпизодическим и в нем могут быть измененные варианты возбудителя, в том числе L-формы. Поэтому для повышения вероятности обнаружения микобактерий туберкулеза используют фазово-контрастную и люминесцентную микроскопию (РИФ). Для РИФ используют диагностические сыворотки, содержащих меченые флюорохромом антитела к антигенам L-форм.
Применяют методы гомогенизации и флотации, позволяющие сконцентрировать туберкулезные микобактерии.
Метод гомогенизации. К суточному объему мокроты добавляют равный объем 1% едкого натра, плотно закрывают ёмкость и встряхивают ее 15 минут до полной гомогенизации мокроты, центрифугируют, сливают жидкую часть, осадок нейтрализуют 1-2 каплями 10% раствора соляной кислоты. Из осадка, в котором сконцентрированы туберкулезные микобактерии готовят мазок, окрашивают по Цилю-Нильсену и микроскопируют.
Метод флотации. После обработки едким натром, как указано выше, гомогенизированную мокроту помещают в колбу с резиновой пробкой. Колбу прогревают на водяной бане при 55°С 30 минут, добавляют 1-2 мл ксилола, толуола или бензина, после чего разводят дистиллированной водой до горлышка колбы. Смесь встряхивают 10 - 15 минут, после чего отстаивают в течение 15-20 минут. Осторожно отбирают и переносят пипеткой на предметное стекло образованный сливкообразный слой. Стекло кладут на закрытую водяную баню. На высохший мазок наслаивают новую порцию материала и снова подсушивают. Наслоения с последующим высушиванием проводят 5-6 раз. Сухой препарат несколько раз промывают эфиром, мазок фиксируют и окрашивают по Цилю-Нильсену. Флотация повышает выявления микобактерий в патологическом материале на 10%. Отрицательный результат микроскопии не может свидетельствовать на 100% об отсутствии микобактерий в исследуемом материале, поэтому результат микроскопического исследования является лишь ориентировочным.
Бактериологический метод. Этот метод является более достоверным и применяется в тех случаях, когда микроскопическое исследование не дало положительных результатов. Метод позволяет выделить чистую культуру бактерий с последующей дифференциацией микобактерий с учетом скорости их роста и ряда биохимических свойств.
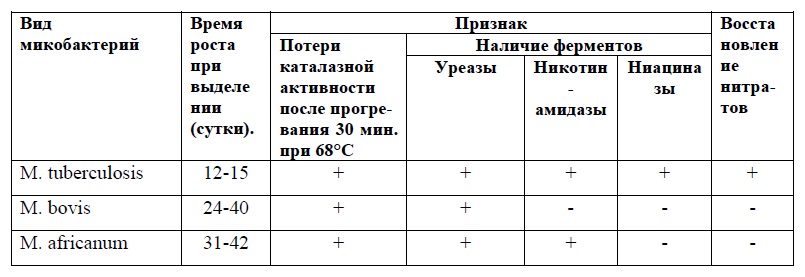
Дифференциальные признаки некоторых микобактерий
В исследуемом материале перед посевом на питательные среды должны быть уничтожены посторонние бактерии. Для этого патологический материал обрабатывают слабым раствором серной кислоты (6-12%), что убивает все бактерии, кроме кислотоустойчивых. После обработки кислотой мокроту встряхивают и центрифугируют. Полученный осадок отмывают от серной кислоты путем 20-30 минутного центрифугирования в стерильном физиологическом растворе. Отмытый осадок высевают на среды Левенштейна-Йенсена, Финн-2. После посева пробирки со средами заливают расплавленным парафином и помещают в термостат на 3-4 недели.
Посевы просматривают раз в неделю. Рост микобактерий туберкулеза обычно выявляется на 3-4й неделе, но иногда и через 2,5-3 месяца. Микобактерии туберкулеза дают, как правило, сухие, морщинистые, грубые (напоминающие бородавки) колонии, обычно R-формы. Колонии плохо снимаются со среды
, а при прокаливании бактериологической петли в пламени дают характерный треск. S-форма колоний с пигментацией желтого цвета свойственна и другим микобактериям. В мазках, приготовленных из колоний и окрашенных по Цилю-Нильсену, регистрируются скопления типичных микобактерий. В молодых культурах, выделенных от больных, которых лечили антибактериальными препаратами, можно найти микроорганизмы измененной формы в виде коротких палочек или шаров. Для более быстрого выделения туберкулезных микобактерий предложены ускоренные методы культивирования.
Метод микрокультур Прайса. Материал от больного центрифугируют. Осадок наносят толстым слоем на стерильное предметное стекло. Высушенный препарат погружают на 5 минут в 5% серную кислоту для уничтожения посторонней микрофлоры, а затем в стерильный физиологический раствор для удаления кислоты. После этого препарат погружают в стакан с питательной средой (цитратная кровь, разведенная дистиллированной водой 1:4) и помещают в термостат. Рост туберкулезных микобактерий обнаруживают под микроскопом уже через 48-72 часа. Препараты окрашивают по Цилю-Нильсену и микроскопируют. Микроколонии возбудителя туберкулеза выглядят как косы, жгуты или массивные скопления. Данный способ позволяет видеть рост туберкулезных бактерий на той стадии, когда макроскопически его обнаружить не удается, но метод микрокультур не дает возможности изучать свойства бактериальных культур.
Глубинный метод посева по Школьниковой. Исследуемый материал центрифугируют и к осадку добавляют равный объем 2% серной кислоты. Перемешивают и центрифугируют 15-20 минут. Осадок промывают стерильным физиологическим раствором. 2-3 капли осадка засевают в глубину среды (цитратная кровь, разведенная дистиллированной водой 1: 4), разлитой по 5 мл в 3 пробирки. Посевы помещают в термостат. Учёт микробного роста выполняют на десятые сутки. Готовят мазки, окрашивают по Цилю-Нильсену и микроскопируют. При положительном результате посева в мазке обнаруживают микроскопические колонии бактерий туберкулеза, имеющие вид кос или жгутов.
Начало формы
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА
Биологический метод. Этот метод является наиболее чувствительным и дает положительные результаты при введении морским свинкам даже единичных туберкулезных микобактерий. Исследуемый материал обрабатывают серной кислотой, освобождая от посторонней микрофлоры, и вводят подкожно двум морским свинкам массой 250-300 г в область паха. При наличии туберкулезных микобактерий через 6-10 дней в месте введения патологического материала появляется уплотнение (инфильтрат) на поверхности которого образуется язва. Из гноя язвы делают мазки, окрашивают по Цилю-Нильсену. При положительном результате животное теряет вес и через 4-6 недель погибает. При вскрытии трупа обнаруживают туберкулезные бугорки в органах. В мазках из бугорков находят туберкулезные микобактерии. При малом количестве исследуемого материала животных инфицируют внутрибрюшинно или интратестикулярно. Такой способ заражения повышает чувствительность метода, особенно в тех случаях, когда в материале содержатся маловирулентные устойчивые к изониазиду микобактерии туберкулеза. В последнее время все шире практикуется интрацеребральное заражение белых мышей. Основное отличие M. bovis от M. tuberculosis заключается в их патогенности для кроликов. В случае внутривенного заражения кролика культурой M. bovis кролик погибает от генерализованного туберкулеза через 3-6 недель. К заражению M. tuberculosis кролики резистентные.
Серологический метод является вспомогательным. Предложены различные реакции, позволяющие выявить антитела к антигенам микобактерий, например, РСК, РПГА. Однако эти реакции или недостаточно специфичны, или требуют дифференциальной диагностики при ложноположительных результатах.
Аллергологический метод. Применяют для определения инфицированности населения туберкулезными микобактериями. Внутрикожную туберкулиновую пробу Манту применяют для диагностики туберкулеза у детей и перед ревакцинацией. Для постановки пробы берут «туберкулиновый» шприц объемом 1 мл и иглы с коротким срезом. В кожу средней трети внутренней поверхности предплечья вводят 0,1 мл очищенного туберкулина в стандартном разведении. Результаты пробы Манту оценивают через 48-72 часа. Величину папулы измеряют при помощи прозрачной миллиметровой линейки. Регистрируют поперечный (по отношению к оси руки) диаметр папулы. Зону гиперемии при этом не учитывают.
При величине папулы от 0 до 1 мм в диаметре реакция считается отрицательной, от 2 до 4 мм - сомнительной, а 5 мм и более - положительной.
Конец формы
Менингококки. Морфология и общие свойства
Менингококки (N.meningitidis), вызывающие у людей менингококковую инфекцию, впервые изучены А.Ваксельбаумом в 1887 г.
Клетки менингококка имеют сферическую или слегка овоидную форму. В препаратах, приготовленных из спинномозговой жидкости, клетки располагаются попарно. Обращенные друг к другу поверхности уплощены. Хорошо окрашиваются анилиновыми красителями, имеют микрокапсулу и пили. Спор не образуют. Менингококки хемоорганотрофы, требовательны к условиям культивирования; аэробы, обладают цитохромоксидазой и каталазой. Культивируют менингококки на средах, содержащих нормальную сыворотку или дефибринированную кровь барана либо лошади. На сывороточном агаре образуют бесцветные нежные колонии вязкой консистенции. Рост менингококков стимулируется в условиях повышенной концентрации СО и повышенной влажности. Менингококки проявляют слабую сахаролитическую активность, расщепляют с образованием кислоты глюкозу и мальтозу. Образуют гиалуронидазу и нейраминидазу.
Менингококки. Антигенные и вирулентные свойства
Антигенные свойства
У менингококков различают несколько антигенов. На основании иммунохимических различий капсульных антигенов менингококки делят на серовары A, B, C, D, X, Y, Z, W-135, 29E.
Антигенами, разделяющими менингококки на подварианты, являются белки наружной мембраны клеточной стенки. Эти антигены обозначают арабскими цифрами. Заболевания чаще всего вызывают менингококки сероваров А, В, и С. Менингококки серовара А наиболее часто встречаются при генерализованных формах инфекции.
Патогенность
Факторами вирулентности менингококков являются капсульные полисахариды, обеспечивающие их резистентность к фагоцитозу, пили. С помощью которых бактерии прикрепляются к рецепторам эпителиальных клеток. Адгезивную функцию несут также белки наружной мембраны клеточной стенки. Менингококки продуцируют нейраминидазу и гиалуронидазу, способствующие их инвазии в ткани. Менингококки образуют эндотоксин – ЛПС клеточной стенки, который часто обнаруживается у больных в крови и спинномозговой жидкости. Он играет ведущую роль в развитии генерализованных форм инфекции и может вызвать эндотоксический шок.
Лабораторная диагностика менингококковой инфекции. Микроскопический метод


