ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 39
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
редставители: Гидроксибутират, ацетоацетат, и ацетон. Норма в крови – 0,2 ммоль/л. Кетоновые тела – это способ транспорта ацетильной группы. Синтез кетоновых тел протекает только в гепатоцитах (митохондриях). Коферментом синтеза кетоновых тел является КоА. Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК. Механизм развития гиперкетонемии. Для понимания причин развития кетонемии при различных ситуациях необходимо понимать роль оксалоацетата для регуляции цикла трикарбоновых кислот. При голодании соотношение инсулин/глюкагон низкое и поэтому в печени активно идет глюконеогенез, для которого используется оксалоацетат (смещается соотношение ацетил-КоА и ОА в сторону первого) Поэтому при голодании жирные кислоты, поступающие в большом количестве в печень, не сгорают в ЦТК (из-за недостатка ОА), а уходят в синтез кетоновых тел. При длительной мышечной нагрузке резервы гликогена в печени истощаются, развивается тенденция к гипогликемии и секретируется глюкагон, который усиливает глюконеогенез, при этом количество оксалоацетата снижается, и жирные кислоты, попавшие в печень, будут окисляться с образованием кетоновых тел. Регуляция синтеза кетоновых тел: 1) ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови. 2) ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А (KoA). 3) Чем меньше концентрация КоА, тем выше активность ГМГ -КоА-синтазы.
ТАГ – основной источник энергии, у взрослого человека 19-23%. Состоит из глицерола и 3 остатков ВЖК (Ацилы). Выделяют простые и смешанные (Простые – это одна и таже ВЖК). Синтез и распад ТАГ происходит в цитозоле, но окисление ЖК в митохондриях. Роль: 1) Энергетическая 2) Обеспечивание механической защиты 3) Теплосберегающая.
Синтез ТАГ
П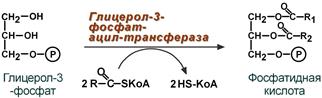 ри увеличении концентрации инсулина, будет происходить активация синтеза ТАГ. А при повышении контринсулярных гормонов – липолиз.
ри увеличении концентрации инсулина, будет происходить активация синтеза ТАГ. А при повышении контринсулярных гормонов – липолиз.
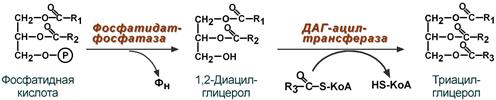
Распад ТАГ и регуляция
Липопротеин представляет собой сферическую структуру, гидрофобная сердцевина которой состоит из ТАГ и эфиров холестерола (ЭX), и гидрофильную оболочку, в составе которой фосфолипиды, гликолипиды и белки. Белки – входящие в основную часть называются апобелками. 1) Хиломикроны (B-48, AпоС-II, АпоЕ) – образуются в клетках кишечника, их функция: перенос экзогенного жира и холестерина в печень. 2) ЛПОНП (B-100, AпоС-II, АпоЕ) – образуются в печени, их роль: Транспорт эндогенного жира, синтезированного в печени в жировую ткань. 3) ЛПНП (B-100) – образуются в кровеносном русле из ЛПОНП через стадию образование ЛППП (B-100, АпоЕ). Роль – транспорт эндогенного холестерина в ткани. 4) ЛПВП (АпоА-I, АпоС-II, АпоЕ) – образуются в печени, основная роль – транспорт холестерина из тканей в печень (Удаление холестерина из тканей). Апопротеины: В-48 основной белок ХМ, В-100 основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП; С-II активатор липопротеинлипазы (ЛП-липазы), переносится с ЛПВП на ХМ и ЛПОНП в крови; Е участвует в связывании липопротеинов с рецепторами ЛПНП и другими рецепторами, А-I активатор лецитинхолестеринацилтрансферазы (ЛХАТ). Когда хиломикроны проходят по кровеносным капиллярам клеток жировой, мышечной или другой ткани, они взаимодействуют с ферментом липопротеинлипазой (ЛП-липазой), которая фиксирована на поверхности эндотелиальных клеток, выстилающих стенки капилляров. AпоС-II и фосфолипиды находятся на поверхности ХМ: 1) АпоС – кофермент ЛП-липазы, изменяет ее конформацию, тем самым формируя ее активный центр. 2) Фосфолипиды опознаются и связываются с ферментом, а
ЛП-липаза катализирует гидролиз ТАГ в ХМ до глицерина и ВЖК. (на поверхности печени – печеночная липаза, которая действует на ЛППП, но не действует на ХМ). ЛПОНП содержит одну молекулу белка апоВ-100. Другие белковые компоненты, апоС-II, апоС-III и апоЕ, поступают на неё от ЛПВП после того, как ЛПОНП попадают в плазму крови. Они требуются для ускорения метаболизма ЛПОНП. На эндотелии сосудистой стенки ТАГ в составе ЛПОНП подвергаются действию фермента ЛП-липазы. ЛП-липаза катализирует гидролиз ТАГ в составе ЛПОНП до жирных кислот, моноацилглицеролов. После гидролиза жиров ЛП-липазой образуются остаточные ЛПОНП, называемые липопротеинами промежуточной плотности (ЛППП). Эти липопротеины либо поглощаются печенью, либо превращаются в липопротеины низкой плотности (ЛПНП). В печени около 75% ЛППП поглощается и разрушается, остальные 25% подвергаются действию печеночной липазы – катализирует расщепление ТАГ в составе ЛППП превращая их в ЛПНП (Около 70% холестерина и его эфиров в крови находится в составе ЛПНП). В клетках-потребителяххолестерина существуют рецепторы для ЛПНП, которые взаимодействуют с АпоB-100, что приводит к эндоцитозу ЛПНП. Липопротеины, циркулирующие в крови, обмениваются холестерином. Особенно активно это происходит между ЛПНП и ЛПВП, причем поток холестерина направлен в сторону ЛПВП. Неэтерифицированный (не эфир) холестерин находится в поверхностном монослое липопротеинов. ЛПВП способны этерифицировать (образовывать эфиры) холестерин с помощью лецитин-холестерин-ацилтрансферазы (ЛХАТ) (примембранная, есть еще и внутриклеточная – ацетилхолестеролацилтрансфераза (АХАТ)) катализирующей сначала отщепление ацильного остатка из фосфатидилхолина (фосфолипид), а потом его перенос на холестерин. (Зачем нужно этерифицировать ХС? Чтобы транспортировать его). Эфир холестерина погружается внутрь ЛПВП, освобождая место для новых молекул холестерина в поверхностном слое. Двусторонняя диффузия холестерина происходит и при контакте ЛПВП с клетками, при этом ЛПВП извлекают холестерин из мембран клеток. ЛПВП, нагруженные холестерином, поглощаются в основном печенью путем эндоцитоза и там освобождают холестерин. Нарушение соотношения между ЛПНП и ЛПВП может быть причиной гиперхолестеринемии. Потребление холестерина клеткой регулируется путем изменения количества рецепторов на поверхности клетки. При снижении потребности клетки в холестерине уменьшается количество рецепторов. Регулятором является сам холестерин, который репрессирует транскрипцию генов, соответствующих этим белкам. Синтез рецепторов ЛПНП увеличивают гормоны: инсулин, трийодтиронин, половые гормоны, а уменьшают глюкокортикоиды.
Атерогенные липопротеиды – способтвующие образованию атеросклеротических бляшек. Это ЛПНП, ЛППП, ЛПОНП. Антиатерогенные – ЛПВП – так как, наоборот выводят холестерин из организма. И неатерогенные – ХМ, почти не имеет в своем составе холестерина, поэтому не как не влияет на его обмен.
Х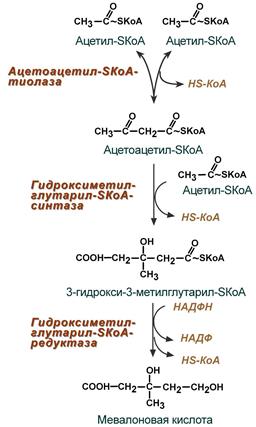
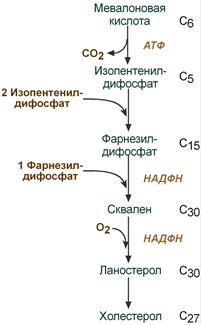
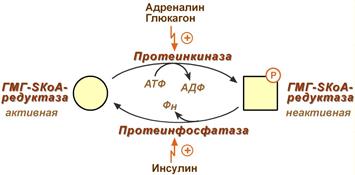 олестерин – ненасыщенный спирт. Роль: 1) Структурная – входит в состав мембран, повышая их вязкость и жесткость. 2) Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности 3) Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D. Регуляция синтеза холестерола: Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза 1) Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. 2) Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента 3) Ковалентная модификация при гормональной регуляции:
олестерин – ненасыщенный спирт. Роль: 1) Структурная – входит в состав мембран, повышая их вязкость и жесткость. 2) Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности 3) Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D. Регуляция синтеза холестерола: Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза 1) Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. 2) Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента 3) Ковалентная модификация при гормональной регуляции:
Ковалентная модификация (фосфорилирование)
Выведение из организма: 1) С фекалиями в виде желчных кислот и образованных микрофлорой нейтральный стеролов – холестанола и копростанола 2) В составе ороговевающего эпителия кожи и кожного сала 3) В виде стероидных гормонов в составе мочи
Предшественником желчных кислот и стероидных гормонов является холестерол. Состав желчи: 1) Желчный кислоты и соли 2) Вода 3) Билирубин 4) Бикарбонаты 5) Холестерол 6)Фосфолипиды (фосфотидилхолин). Роль желчи: 1) Наряду с панкреатическим соком – нейтрализация кислой среды. 2) Обеспечивает переваривание жиров :а) Эмульгирование б)Препятсвие слиянию капель жира в) Образование мицелл, способных всасываться 3)Обеспечение всасыванию витаминов (мицеллы) 4) Усиление перестальтики кишечника 5) Выведение ХС, билирубина, металлов и лекарств. Желчнокаменная болезнь - патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол. Выделение холестерола в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы холестерола в жёлчи в мицеллярном состоянии. Диспропорции количества холестерола и жёлчных кислот (в пользу ХС) приводят к тому, что ХС начинает осаждаться в желчном пузыре, образуя камни. Иногда он может пропитываться билирубином – образуя смешанные камни. Механизмы образования камней: 1) Избыточная секреция холестерина, которая может быть вызвана :а) Высококалорийной диетой б) Лекарствами в) Повышением активное ГМГ-КоА-редуктазы. 2)Пониженная секреция желчных кислот и фосфолипидов – еще один фактор литогенности (способностью к камнеобразованию) желчи. (Может быть вызвана гипосекрецией желчный кислот, нарушением в обратном всасывании, нарушение в работе фермента 7 – альфа-гидроксилазы – фермент, учавствующий в синтезе первичных желчных кислот.
Холестерин транспортируется в составе липопротеинов низкой плотности (эндогенный ХС к тканям) и высокой плотности (из тканей в печень). Норма в крови
-
Триацилглицеролы (основной компонент адипоцитов), особенности строения, роль в зависимости от локализации в организме. Схемы анаболизма и катаболизма ТАГов, метаболиты, ключевые ферменты, коферменты, механизмы регуляции процессов.
ТАГ – основной источник энергии, у взрослого человека 19-23%. Состоит из глицерола и 3 остатков ВЖК (Ацилы). Выделяют простые и смешанные (Простые – это одна и таже ВЖК). Синтез и распад ТАГ происходит в цитозоле, но окисление ЖК в митохондриях. Роль: 1) Энергетическая 2) Обеспечивание механической защиты 3) Теплосберегающая.
Синтез ТАГ
П
 ри увеличении концентрации инсулина, будет происходить активация синтеза ТАГ. А при повышении контринсулярных гормонов – липолиз.
ри увеличении концентрации инсулина, будет происходить активация синтеза ТАГ. А при повышении контринсулярных гормонов – липолиз. 
Распад ТАГ и регуляция

-
Липопротеины (транспортные формы липидов), общая схема строения, особенности состава, места формирования, роль ХМ, ЛПНП, ЛППП, ЛПОНП, ЛПВП. Значение липопротеидлипазы, ЛХАТ, апоС-II, апоЕ, апоВ48, апоВ100 в их обмене. Понятие об атерогенных и антиатерогенных фракциях.
Липопротеин представляет собой сферическую структуру, гидрофобная сердцевина которой состоит из ТАГ и эфиров холестерола (ЭX), и гидрофильную оболочку, в составе которой фосфолипиды, гликолипиды и белки. Белки – входящие в основную часть называются апобелками. 1) Хиломикроны (B-48, AпоС-II, АпоЕ) – образуются в клетках кишечника, их функция: перенос экзогенного жира и холестерина в печень. 2) ЛПОНП (B-100, AпоС-II, АпоЕ) – образуются в печени, их роль: Транспорт эндогенного жира, синтезированного в печени в жировую ткань. 3) ЛПНП (B-100) – образуются в кровеносном русле из ЛПОНП через стадию образование ЛППП (B-100, АпоЕ). Роль – транспорт эндогенного холестерина в ткани. 4) ЛПВП (АпоА-I, АпоС-II, АпоЕ) – образуются в печени, основная роль – транспорт холестерина из тканей в печень (Удаление холестерина из тканей). Апопротеины: В-48 основной белок ХМ, В-100 основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП; С-II активатор липопротеинлипазы (ЛП-липазы), переносится с ЛПВП на ХМ и ЛПОНП в крови; Е участвует в связывании липопротеинов с рецепторами ЛПНП и другими рецепторами, А-I активатор лецитинхолестеринацилтрансферазы (ЛХАТ). Когда хиломикроны проходят по кровеносным капиллярам клеток жировой, мышечной или другой ткани, они взаимодействуют с ферментом липопротеинлипазой (ЛП-липазой), которая фиксирована на поверхности эндотелиальных клеток, выстилающих стенки капилляров. AпоС-II и фосфолипиды находятся на поверхности ХМ: 1) АпоС – кофермент ЛП-липазы, изменяет ее конформацию, тем самым формируя ее активный центр. 2) Фосфолипиды опознаются и связываются с ферментом, а
ЛП-липаза катализирует гидролиз ТАГ в ХМ до глицерина и ВЖК. (на поверхности печени – печеночная липаза, которая действует на ЛППП, но не действует на ХМ). ЛПОНП содержит одну молекулу белка апоВ-100. Другие белковые компоненты, апоС-II, апоС-III и апоЕ, поступают на неё от ЛПВП после того, как ЛПОНП попадают в плазму крови. Они требуются для ускорения метаболизма ЛПОНП. На эндотелии сосудистой стенки ТАГ в составе ЛПОНП подвергаются действию фермента ЛП-липазы. ЛП-липаза катализирует гидролиз ТАГ в составе ЛПОНП до жирных кислот, моноацилглицеролов. После гидролиза жиров ЛП-липазой образуются остаточные ЛПОНП, называемые липопротеинами промежуточной плотности (ЛППП). Эти липопротеины либо поглощаются печенью, либо превращаются в липопротеины низкой плотности (ЛПНП). В печени около 75% ЛППП поглощается и разрушается, остальные 25% подвергаются действию печеночной липазы – катализирует расщепление ТАГ в составе ЛППП превращая их в ЛПНП (Около 70% холестерина и его эфиров в крови находится в составе ЛПНП). В клетках-потребителяххолестерина существуют рецепторы для ЛПНП, которые взаимодействуют с АпоB-100, что приводит к эндоцитозу ЛПНП. Липопротеины, циркулирующие в крови, обмениваются холестерином. Особенно активно это происходит между ЛПНП и ЛПВП, причем поток холестерина направлен в сторону ЛПВП. Неэтерифицированный (не эфир) холестерин находится в поверхностном монослое липопротеинов. ЛПВП способны этерифицировать (образовывать эфиры) холестерин с помощью лецитин-холестерин-ацилтрансферазы (ЛХАТ) (примембранная, есть еще и внутриклеточная – ацетилхолестеролацилтрансфераза (АХАТ)) катализирующей сначала отщепление ацильного остатка из фосфатидилхолина (фосфолипид), а потом его перенос на холестерин. (Зачем нужно этерифицировать ХС? Чтобы транспортировать его). Эфир холестерина погружается внутрь ЛПВП, освобождая место для новых молекул холестерина в поверхностном слое. Двусторонняя диффузия холестерина происходит и при контакте ЛПВП с клетками, при этом ЛПВП извлекают холестерин из мембран клеток. ЛПВП, нагруженные холестерином, поглощаются в основном печенью путем эндоцитоза и там освобождают холестерин. Нарушение соотношения между ЛПНП и ЛПВП может быть причиной гиперхолестеринемии. Потребление холестерина клеткой регулируется путем изменения количества рецепторов на поверхности клетки. При снижении потребности клетки в холестерине уменьшается количество рецепторов. Регулятором является сам холестерин, который репрессирует транскрипцию генов, соответствующих этим белкам. Синтез рецепторов ЛПНП увеличивают гормоны: инсулин, трийодтиронин, половые гормоны, а уменьшают глюкокортикоиды.
Атерогенные липопротеиды – способтвующие образованию атеросклеротических бляшек. Это ЛПНП, ЛППП, ЛПОНП. Антиатерогенные – ЛПВП – так как, наоборот выводят холестерин из организма. И неатерогенные – ХМ, почти не имеет в своем составе холестерина, поэтому не как не влияет на его обмен.
-
Холестерин, особенности строения, роль. Схема его синтеза, метаболиты, ферменты, коферменты (активные формы витаминов), регуляция процесса. Пути выведения холестерола из организма.
Х


 олестерин – ненасыщенный спирт. Роль: 1) Структурная – входит в состав мембран, повышая их вязкость и жесткость. 2) Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности 3) Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D. Регуляция синтеза холестерола: Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза 1) Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. 2) Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента 3) Ковалентная модификация при гормональной регуляции:
олестерин – ненасыщенный спирт. Роль: 1) Структурная – входит в состав мембран, повышая их вязкость и жесткость. 2) Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности 3) Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D. Регуляция синтеза холестерола: Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза 1) Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. 2) Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента 3) Ковалентная модификация при гормональной регуляции:Ковалентная модификация (фосфорилирование)
Выведение из организма: 1) С фекалиями в виде желчных кислот и образованных микрофлорой нейтральный стеролов – холестанола и копростанола 2) В составе ороговевающего эпителия кожи и кожного сала 3) В виде стероидных гормонов в составе мочи
-
Желчь, химический состав, факторы, поддерживающие растворимую форму холестерина. Механизмы формирования холестериновых камней при желчнокаменной болезни.
Предшественником желчных кислот и стероидных гормонов является холестерол. Состав желчи: 1) Желчный кислоты и соли 2) Вода 3) Билирубин 4) Бикарбонаты 5) Холестерол 6)Фосфолипиды (фосфотидилхолин). Роль желчи: 1) Наряду с панкреатическим соком – нейтрализация кислой среды. 2) Обеспечивает переваривание жиров :а) Эмульгирование б)Препятсвие слиянию капель жира в) Образование мицелл, способных всасываться 3)Обеспечение всасыванию витаминов (мицеллы) 4) Усиление перестальтики кишечника 5) Выведение ХС, билирубина, металлов и лекарств. Желчнокаменная болезнь - патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол. Выделение холестерола в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы холестерола в жёлчи в мицеллярном состоянии. Диспропорции количества холестерола и жёлчных кислот (в пользу ХС) приводят к тому, что ХС начинает осаждаться в желчном пузыре, образуя камни. Иногда он может пропитываться билирубином – образуя смешанные камни. Механизмы образования камней: 1) Избыточная секреция холестерина, которая может быть вызвана :а) Высококалорийной диетой б) Лекарствами в) Повышением активное ГМГ-КоА-редуктазы. 2)Пониженная секреция желчных кислот и фосфолипидов – еще один фактор литогенности (способностью к камнеобразованию) желчи. (Может быть вызвана гипосекрецией желчный кислот, нарушением в обратном всасывании, нарушение в работе фермента 7 – альфа-гидроксилазы – фермент, учавствующий в синтезе первичных желчных кислот.
-
Холестерин, транспорт по кровотоку в составе липопротеинов, содержание в крови в норме. Основные причины развития гиперхолестеролемии, молекулярные механизмы и этапы формирования атеросклеротической бляшки. Расчет коэффициента атерогенности.
Холестерин транспортируется в составе липопротеинов низкой плотности (эндогенный ХС к тканям) и высокой плотности (из тканей в печень). Норма в крови

