ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 112
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Гиббстің еркін энергиясы анықталатын формула:
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
«Физикалық химия» пәнінен 6В07201 - «Фармацевтикалық өндіріс технологиясы» мамандығының студенттеріне арналған
ТЕСТ ТАПСЫРМАЛАРЫ
2021-2022 оқу жылы
-
Химиялық термодинамика зерттейді:
химиялық энергияның электрлік, жылулық, механикалық, беттік және т.б. түрлеріне айналуының негізгі заңдылықтарын.
-
Ашық термодинамикалық жүйе қоршаған ортамен алмасады:
қоршаған ортамен массасымен және энергиясымен алмасады.
-
Гетерогендік жүйе:
екі және одан да көп фазалардан тұрады.
-
Гомогендік жүйедегі фазалар саны φ:
φ=1
-
Гетерогендік жүйедегі фазалар саны φ:
φ>1
-
Гомогендік термодинамикалық жүйе:
әрбір нүктесінде қасиеттері бірдей және бір фазадан тұрады.
-
Келтірілген термодинамикалық параметрлердің ішінен термодинамикалық функцияларды таңдаңыз:
H
-
Келтірілген термодинамикалық параметрлердің ішінен термодинамикалық функцияларды таңдаңыз:
S
-
Интенсивтік термодинамикалық параметрлерді таңдаңыз:
C
-
Тек экстенсивтік термодинамикалық параметрлерді таңдаңыз:
m, V, U, H, G
-
Тікелей өлшенетін келесі термодинамикалық параметрлер:
масса
-
Келтірілген термодинамикалық жүйелерден гетерогендік жүйені табыңыз:
жүйе: сұйық су – мұз
-
Жабық термодинамикалық жүйелерді таңдаңыз:
суыған тас
-
Ашық термодинамикалық жүйені таңдаңыз:
өсімдік.
-
Тікелей өлшенетін термодинамикалық жүйе параметрлерін айтады:
негізгі
-
Тікелей өлшенбейтін термодинамикалық жүйе параметрлерін айтады:
күй функциясы
-
Адам термодинамикалық жүйе ретінде болып табылады:
гетерогендік, ашық.
-
Эндотермиялық реакциялар үшін:
Q<0, ∆H>0
-
Экзотермиялық реакциялар үшін:
Q>0, ∆H<0
-
Термодинамиканың бірінші заңының математикалық өрнектелуі:
Q=∆U + A
-
Экзотермиялық реакцияларда:
жылу бөлінеді
-
Эндотермиялық реакцияларда:
жылу сіңіріледі
-
Термодинамикалық функция болып табылады:
U
- 1 2 3 4 5 6 7 8 9 ... 12
Гиббстің еркін энергиясы анықталатын формула:
∆G = ∆H - T∆S
-
∆G = ∆H - T∆S теңдеуіндегі T∆S шамасы сипаттайды:
жүйенің байланысқан энергиясын.
-
Джоульмен өлшенетін физикалық шамаларды таңдаңыз:
жылу мөлшері
-
Жылусыйымдылықтың өлшем бірліктерін анықтаңыз:
Дж/моль*К
-
Келтірілген заттардан қайсысының түзілу жылу нөльге тең:
Н2
-
Энтропия өзгерісі ∆S>0 болатын реакцияны табыңыз:
2Н2О = 2H2 + O2
-
Энтропия өлшем бірліктерін табыңыз:
Дж/мольК
-
Абсолюттік ноль температурасында дербес кристалл затының энтропиясы нөлге тең:
термодинамиканың үшінші заңы
-
Қайтымды изобаралық-изотермиялық процессте жүйе жасайтын максималды жұмыс абсолюттік шамасы бойынша тең:
Гиббс энергиясына
-
Қайтымды изохоралық- изотермиялық процессте жүйе жасайтын максималды жұмыс абсолюттік шамасы бойынша тең:
Гельмгольц энергиясына
-
кДж/моль өлшенетін шамалар:
∆H
-
Химиялық жүйенің реакциялық қабілетін анықтайтын шама
Гиббс энергиясы
-
«Мұз-су-бу» жүйесінің құрамында:
бір компонент, инвариантты
-
Q=∆H формуласы:
изобаралық процестің жылулық эффектісі
-
Q=∆U формуласы:
изохоралық процестің жылулық эффектісі
-
Жылу суық денеден ыстық денеге өте алмайды:
термодинамиканың екінші заңы
- Термодинамиканың жүйенің бір түрінен екінші түріне өтуінде энергия жоқ болып кете алмайды, жоқтан пайда бола алмайды, тек бір күйден 2-шіге ауысқанда қатаң эквивалентті қатынас жүреді:
термодинамиканың бірінші заңы
- Реакцияның жылу эффектісі жүру жолына тәуелді емес, бастапқы және өнім заттарының күйіне және табығатына тәуелді:
Гесс заңы
-
Температураны өзгерткендегі реакцияның жылу эффектісінің өзгерісі жылу сыйымдылыққа тең болады:
Кирхгофф заңы
-
«Дәнекерленген ампуладағы глюкозаның сұйытылған ерітіндісі» термодинамикалық жүйесі:
Жабық, гомогенді
-
«Жабық ампуладағы изотоникалық ерітінді» термодинамикалық жүйесі:
Ашық, гомогенді
- 1 2 3 4 5 6 7 8 9 ... 12
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
изобаро-изотермиялық
-
Изобаралық термодинамикалық процесске тән:
QP= ΔН
-
Изобаралық термодинамикалық процесске тән:
-
Температура тұрақтылығы -
Қысым тұрақтылығы -
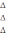 Qv = G
Qv = G -
Qv = U -
Qv = Н.
-
-
Изобаралық-изотермиялық потенциал:
бос энергияның шамасы болып табылады
-
Изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері:
Энтальпия
- Стандартты жағдайда реакция нәтижесінде жай заттардан 1моль күрделі зат түзілгенде бөлінетін немесе сіңірілетін жылу мөлшері:
Стандартты түзілу энтальпиясы
-
Стандартты жағдайда реакция нәтижесінде 1моль күрделі зат жай заттарға ыдырағанда бөлінетін немесе сіңірілетін жылу мөлшері
Стандартты ыдырау энтальпиясы
- С+О2=СО2 +393,5 кДж термохимиялық теңдеуі бойынша көміртек оксидінің (IV) стандартты түзілу жылуын көрсетіңіз:
-
393,5 кДж/моль. 2) -393,5 кДж/моль. 3) -786,4 кДж/моль.
-
-
786,4 кДж/моль. -
120,8 кДж/моль.
- Глюкозаның СО2 және Н2О-ға дейін тотығу үшін ∆Gт=-2879,01 кДж/моль; ∆Нт=- 2801,69 кДж/моль, сондықтан:
Экзотермиялық реакция
-
Тепе-теңдік күйінде:
Тура және кері процестердің жылдамдығына тең
