ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 128
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Гиббстің еркін энергиясы анықталатын формула:
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
- Егер жылдамдық үшін теңдеу
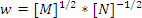 түрінде жазылса, онда реакция ретін анықтаңыз:
түрінде жазылса, онда реакция ретін анықтаңыз:
0
- Егер жылдамдық үшін теңдеу
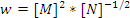 түрінде жазылса, онда реакция ретін анықтаңыз:
түрінде жазылса, онда реакция ретін анықтаңыз:
1,5
- Егер жылдамдық үшін теңдеу
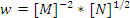 түрінде жазылса, онда реакция ретін -1,5.
түрінде жазылса, онда реакция ретін -1,5.
- Химиялық реакцияның жылдамдық теңдеуі бойынша
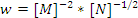 оның ретін анықтаңыз:
оның ретін анықтаңыз:
-2,5.
- Химиялық реакцияның жылдамдық теңдеуі бойынша
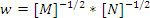 оның ретін анықтаңыз:
оның ретін анықтаңыз:
-1.
-
2А+В=2С реакция үшін:
Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A*CB.
-
2А+В=2С реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
+W=kC2A*CB.
-
2СО +О2=2СО2 реакция үшін:
Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO*Co2.
- 2CO +O2=2CO2 реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
-
W=kC2CO+Co2. -
W=kC2CO*Co2. -
W=kC2co2. -
W= C2co2. -
W= kCco2.
- Температураны 250С-тен 45 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:
9 есе артады.
- Температураны 50 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=2 болса:
32 есе артады.
- Температураны 400С-ға төмендесе реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:
81 есе кемиді.
- Егер ұсынылған стехиометриялық реакция теңдеуі 2CO +O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:
3.
- Егер ұсынылған стехиометриялық реакция теңдеуі 2NO +O2=2NO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:
3.
- Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:
8 есе артады.
- Ыдыстың көлемін 3 есе азайтса, 2CO +O2=2CO2 реакция жылдамдығы:
-
Өзгермейді. -
9 есе артады. -
9 есе кемиді. -
27 есе артады. -
27 есе кемиді.
- Реакция зонасында қысымды 3 есе арттырса, 2CO +O2=2CO2 реакция жылдамдығы:
27 есе артады.
- 1 ... 4 5 6 7 8 9 10 11 12
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
есе артады
- Ыдыстың көлемін 3 есе азайтса, 2NO +O2=2NO2 реакция жылдамдығы:
-
Өзгермейді. -
9 есе артады. -
6 есе кемиді. -
27 есе артады. -
54 есе кемиді.
-
-
Реакция зонасында қысымды 3 есе арттырса, , 2NO +O2=2NO2 реакция жылдамдығы:
27 есе артады.
-
Әрекеттесуші заттардың концентрациясының уақыт бірлігінде өзгертетін графикалық тәуелділігі аталады:
Кинетикалық қисық.
-
Реагенттер концентрациясының химиялық реакция жылдамдығына сандық тұрғыдан әсерін сипаттайды:
Әрекеттесуші масалар заңы.
-
Әрекеттесуші масалар заңының авторлары:
Гульберг және Вааге.
-
Химиялық реакция жылдамдығының температураға тәуелділігі анықталады:
Аррениус теңдеуімен.
- Ле- Шатель принципіне сәйкес Н2 +І2=2НІ реакциясын тепе-тендік оңға жылжиды, егер:
Сутектің және йодтың концентрацияларын арттырса.
- Оттектің концентрациясын екі есе арттырса С(т)+ О2(т) =СО2(т) реакция жылдамдығы:
2 есе артады.
- СО концентрациясын 2 есе арттырса, 2СО +О2=2СО реакция жылдамдығы:
4
есе артады.
-
Реакция жылдамдығы тұрақтысының температураға тәуелділігін теңдеу:
Ink= In A – Ea/RT.
-
Катализатор қатысында химиялық реакцияның жылдамдығы артады:
Активтендіру энергиясының азаюы арқылы.
-
w=-dC/dt өрнегі білдіреді:
бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
- 1 ... 4 5 6 7 8 9 10 11 12
w=+dC/dt өрнегі білдіреді:
реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
-
Химиялық реакцияның молекулалылығы:
тек бүтін сан.
-
Реакция жылдамдығының тұрақтысы тәуелді болады:
температураға.
- Егер химиялық реакция жылдамдығы әрекеттесуші заттар концентрациясына тәуелсіз болса,онда реакция реті тең болады:
0.
-
Реакция жылдамдығының теңдеуі W=K[A]1\2 [B]-1 түрінде өрнектелсе реакцияны анықтаңыз:
-1/2.
- Қандай ретті реакция үшін реакция жылдамдығы мен реакция жылдамдығының константасының өлшем бірлігі бірдей:
нөлінші.
-
Катализатор:
реакциянын активтендіру энергиясын төмендетеді.
-
Катализатор әсерінен химиялық реакцияда өзгереді:
активтендіру энергиясы.
-
Нөлінші ретті реакция жылдамдығы тәуелді емес:
реагенттер коецетрациясына.
- Бірінші ретті реакция жылдамдығының тұрақтысын көрсетіңіз, егер жартылай ыдырау уақыты 240с болса:
2,88 10 -3 с -1.
-
Химиялық кинетика зерттейді:
химиялық реакция жылдамдығын.
- Химиялық реакция жылдамдығы үшін теңдеу w = -dC/dt жазылса, онда реакция жылдамдығы
-
газ тәріздес реакция өнімі концентрациясы бойынша.
- аА + bB + cC = mM + nN реакциясы үшін тура реакциясы реті:
a+b+c.
-
2-ші ретті кинетикалық теңдеулер:
w = k.
-
Реакцияның молекулярлығы бола алады
тек қана 1, 2, 3.
-
Келтірілген реакциялардың ішінен тримолекулярлыны таңдаңыз:
