ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 119
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Гиббстің еркін энергиясы анықталатын формула:
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
-
Натрий гидроксиді ерітіндісінің рН-ы нешеге тең болады, егер болса?
болса?
11
-
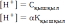 Сірке қышқылы ерітіндісіндегі сутек иондарының концентрациясын қандай формула бойынша есептеуге болады?
Сірке қышқылы ерітіндісіндегі сутек иондарының концентрациясын қандай формула бойынша есептеуге болады?
1)
 2)
2)3),,
-
Коллигативтік қасиеттерге жатады:
ерітінді бетіндегі еріткіштің қаныққан бу қысымының төмендеуі, ерітіндінің қайнау температурасының жоғарылауы, ерітіндінің қату температурасының төмендеуі
-
Таза еріткішпен салыстырғанда ерітіндінің айырмашылығы
қату температурасы төмендейді
- «Таза еріткішке қарағанда бейэлектролит ерітіндісі бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік үлесіне тең»:
Раульдің бірінші заңы
-
Қай теңдеу Вант- Гофф заңына сәйкес келеді:

1
π=CRT
-
Эбулиоскопиялық константа Е:
еріткіш табиғатына тәуелді
-
Криоскопиялық константа К:
еріткіш табиғатына тәуелсіз
-
Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс:
плазмолиз
-
Вена ішіне жіберілетін препарат ретінде қолданылатын дәрілік зат ерітіндісі қан плазмасымен салыстырғанда болу керек:
Изотонды
-
Жоғары осмостық қысымның әсерінен жасушаның осмотикалық серпімділік күйі аталады:
тургор
-
Дәрілік заттардың изотондық концентрациясын есептеуге болады:
Раульдің екінші заңы бойынша
- Теңіз суына шомылғанда көздің қызарып, аздаған ауру белгілерінің сезілуі байланысты:
-
көз алмасынан судың осмосына
-
Ащы суда шомылғанда көздің кенеттен ашып, ауру белгілерінің сезілуі байланысты:
көз алмасының ішіне қарай судың осмосына
-
Егер 2 литр суда 2 моль фруктозаны ерітсе, судың қату температурасы қалай өзгереді? Судың криоскопиялық константасы 1.860:
1.86 градусқа азаяды
-
Ерітінділері үшін изотонды коэффициенті үшке тең болатын заттарды көрсетіңіз:
CuCl2
-
Ерітінділері үшін изотонды коэффициенті бірден ерекшеленетін болатын заттарды көрсетіңіз:
натрий гидрокарбонаты
-
Буферлік ерітінді құрамында:
әлсіз негіз бен оның күшті қышқылмен әрекеттесуінен түзілген тұзынан
-
Сутектік көрсеткіш рН анықталатын формула:
рН=-lgCH+
-
Қышқылдық орта:
pH<7
-
Бейтарап орта:
рН=7
-
Концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісі үшін рН мәні:
1
- 1 2 3 4 5 6 7 8 9 ... 12
Концентрациясы 0,01 моль/л және иондану дәрежесі α=0,001 болатын сірке қышқылы ерітіндісі үшін рН мәні:
4
-
Молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісі үшін рН мәні:
12
- Молярлық концентрациясы 0,01 моль/л ж2не иондану ережесі α=0,001 болатын аммоний гидроксиді ерітіндісі үшін рН мәні:
1) 9
2) 10-10
3) 2
4) 10-5
5) 5
-
250С температурада судың иондық көбейтіндісі:
10-14
-
Қышқылдық буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:
рН=pKk+lg (CkVk/CCVC)
-
Негіздік буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:
рН=14-pKо+lg (CоVо/CсVс)
-
Фосфатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
NaH2PO4+Na2HPO4
-
Гидрокарбонатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
H2CO3+NaHCO3
-
Егер рН 3-ке тең болса:
pOH=11
-
Егер рОН=3, онда:
рН=11
-
Вант-Гофф заңына сәйкес берілген температурада ерітіндінің осмостық қысымы тура пропорциональды болады:
еріген заттың молярлы концентрациясына
-
Белоктардың қатысуынан пайда болатын қысым аталады:
онкотикалық
-
Ерітіген заттың молярлы массасын анықтау үшін мына арақатынас қолданылады:
-
І-изотониялық коэффициент:
электролиттер үшін 1-ден артық
-
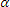 (n-1) + 1 өрнегі ненің мөлшерін анықтайды:
(n-1) + 1 өрнегі ненің мөлшерін анықтайды:
изотониялық коэффициентін
-
Күшті электролиттер теориясын ұсынған:
Дебай и Хюккель
-
Булану кезінде бастапқы заттың құрамы сақталатын ерітінділер:
Азеотропты
-
H2+Cl2→2HCl реакциясы келесі механизм бойынша жүреді Cl2→Cl+Cl (баяу)
Сl+H2→HCl +H (жылдам) Сl+H→HCl (жылдам) Реакция реті тең болады:
1
- M2+N2→2MN реакциясы келесі механизм бойынша жүреді M2→M+M (жылдам)
M+N2→MN+N (баяу) M+N→MN (жылдам) Реакция реті тең болады:
2
- 1 2 3 4 5 6 7 8 9 ... 12
