ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 124
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Гиббстің еркін энергиясы анықталатын формула:
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
жағдайда (СА = СВ = 1)
1) 5∙10-2 (моль/л)-1с-1
2) 2,0 (моль/л)-1с-1
3) 4,2 (моль/л)-1с-1
4) 1,6∙10-3 (моль/л)-1с-1
5) 3,1 (моль/л)-1с-1
1) 1,6 (моль/л)-1с-1
2) 3 (моль/л)-1с-1
3) 4,8 (моль/л)-1с-1
4) 2,4 (моль/л)-1с-1
5) 4 (моль/л)-1с-1
1) n = 0
2) n = 1
3) n > 0
4) n = 2
5) бұл шарттардан реакция реттілігін анықтауға болмайды
екінші ретті қайтымсыз реакцияның жылдамдық константасы анықтағанда қолданылады
1) m γ±
2) 4m3 γ3±
3) 108m5 γ5±
4) m2 γ2±
5) 27m4 γ4±
изохоралық процесте
жүйенің күй функциясы
энтальпия
көлем
V=const
термодинамика
ашық термодинаминамикалық жүйе
шегіне жетеді
–S
жүйенің күй функциясы
кинетикалық
теңдеудегі дәреже көрсеткіштердің қосындысы
екі немесе одан да көп фазадан тұрады
құрамында бір компонент бар, инвариантты
термодинамиканың үшінші заңы
химиялық реакция жүруінің тереңдігін
.
- А + В → С химиялық реакцияның жылдамдығы 0,12 моль/л∙с-1, А және В концентрациялары А = 0,3 моль/л және В = 0,2 моль/л. Реакция жылдамдығының константасы неге тең?
1) 5∙10-2 (моль/л)-1с-1
2) 2,0 (моль/л)-1с-1
3) 4,2 (моль/л)-1с-1
4) 1,6∙10-3 (моль/л)-1с-1
5) 3,1 (моль/л)-1с-1
- 2А→В химиялық реакцияның жылдамдығы 0,48 моль/л∙с-1, А заттың концентрациясы 0,4 моль/л. Реакция жылдамдығының константасы неге тең?
1) 1,6 (моль/л)-1с-1
2) 3 (моль/л)-1с-1
3) 4,8 (моль/л)-1с-1
4) 2,4 (моль/л)-1с-1
5) 4 (моль/л)-1с-1
-
Реакцияның жылдамдық константасы 0,5 (моль/л)-1∙с-1. Реакцияның реттілігі қандай?
1) n = 0
2) n = 1
3) n > 0
4) n = 2
5) бұл шарттардан реакция реттілігін анықтауға болмайды
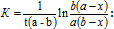 223. Бұл теңдеу:
223. Бұл теңдеу:
екінші ретті қайтымсыз реакцияның жылдамдық константасы анықтағанда қолданылады
- Күшті электролит Na2SO4 –тің моляльдылығы m болатын сулы ерітіндінің компоненті ретіндегі оның активтілігін толық көрсететін өрнек
1) m γ±
2) 4m3 γ3±
3) 108m5 γ5±
4) m2 γ2±
5) 27m4 γ4±
- Тұрақты көлемде бір бағытта жүретін нөлінші ретті реакциясының жылдамдық константасының өлшем бірлігі қандай?
-
моль/л∙с -
л/моль∙с -
л2/моль2∙с -
моль∙л/с -
моль∙с/л
-
Қандай процестерде идеал газдың көлем ұлғаю жұмысы нөлге тең?
изохоралық процесте
- 2SO2(Г) + О2(Г) = 2SO3(Г) бұл жүйе тепе-теңдік күйде болғанда фазасы қандай
-
гетерогенді -
бірфазалы -
екіфазалы -
үшфазалы -
төртфазалы
-
Жалпы жағдайдағы жүйенің ішкі энергиясының қасиеттері
жүйенің күй функциясы
-
Кеңейтілген жүйенің жылу мөлшері дегеніміз, ол -
энтальпия
-
Термодинамикалық жүйенің экстенсивті параметрін көрсетіңіз
көлем
-
Изохоралық үрдістің жүру жағдайы
V=const
-
Жылу мен жұмыстың бірнен-біріне ауысуын оқытатын ғылым
термодинамика
-
Тіріжасушалар қандай термодинамикалық жүйеге жатады
ашық термодинаминамикалық жүйе
-
Оқшауланған термодинаминамикалық жүйенің басқа жүйелерден айырмашылығы қандай ?
-
кеңістікте шектеулі орын алып жатқан, материалдық заттардың жиынтығы -
кеңістікте шектеусіз орын алып жатқан, материалдық заттардың жиынтығы
-
Өзігінен тепе-теңдікке ұмтылғанда оқшауланған жүйенің энтропиясының жағдайы
шегіне жетеді
-
Температура бойынша көлем тұрақты болғанда, жеке заттың Гельмгольц энергиясының жартылай туындысының мәні қандай?
–S
-
Жалпы жағдайда жүйедегі компоненттің химиялық потенциалының қасиеттері,
жүйенің күй функциясы
-
Химиялық реакцияның молекулярлығы дегеніміз-
кинетикалық
теңдеудегі дәреже көрсеткіштердің қосындысы
-
Гетерогенді жүйе:
екі немесе одан да көп фазадан тұрады
-
«мұз-су-бу» жүйесі қанша вариантты?
құрамында бір компонент бар, инвариантты
-
Жүйеде түзілетін диссоциацияланбайтын қосылыстың суыну қисығында:
-
тек бір ғана алаңша болады -
максимум нүктесіболады -
иілу нүктесі болады -
бұрылыс қисиығы болады -
екі алаңша болады
-
Абсолюттік ноль температурасында дербес кристалл затының энтропиясы нөлге тең:
термодинамиканың үшінші заңы
-
Тепе-теңдік константасы сипаттайды:
химиялық реакция жүруінің тереңдігін
.
