ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 117
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Гиббстің еркін энергиясы анықталатын формула:
Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
H2+Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO +O2=2NO2 реакция жылдамдығы:
Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
-
С+О2=СО2+Q1 C+1/2 О2=СО2+Q2 CO+1/2О2=СО2+Q3
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Q1=Q2+Q3
-
N2+O2=2NO+Q1
2NO+O2=2NO2+Q2 N2+2O2=2NO2+Q3
Реакциялары үшін дұрыс пікірлерді таңдаңыз:
Q3=Q1+Q2
-
S+O2=SO2+Q1 SO2+1/2O2=SO3+Q2 S+3/2O2=SO3+Q3
Реакциялары үшін дұрыс емес пікірлерді таңдаңыз: +Q3=Q1+Q2
-
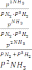 K=
K=
-
K=
-
K= -
K= -
K=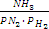
- 1 2 3 4 5 6 7 8 9 ... 12
Энтропия артады:
Газ тәріздес өнімдердің көлемі өсуімен жүретін реакцияларда
-
Энтропия азаяды:
-
Энтропия шамасы кемитін процесс:
Кристалдардың балқуы
-
Энтропия шамасы кемитін процесс:
Сұйықтықтардың конденсациясы
-
Гиббстың бос энергиясы G- жүйе күйінің термодинамикалық функциясы:
Изобаралық- изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды
-
Изобаралық-изотермиялық потенциал G-жүйе күйінің термодинамикалық функциясы:
Бос энергияның шамасы болып табылады
-
Гельмгольц бос энергиясы F-жүйе күйінің термодинамикалық функциясы:
Изохоралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды
- Стандартты жағдайда жүретін 2С+3Н2+1/2О2=С2Н5ОН реакция эффектісі аталады:
Этанолдың түзілу жылуы
-
Гиббс энергиясын есептеу үшін қолданылатын теңдеу:
-
Изохоралық-изотермиялық потенциалды есептеуге болатын теңдеу:
-
Химиялық реакцияның изобаралық теңдеуін көрсетіңіз:
+
-
Химияық реакцияның изохоралық теңдеуін көрсетіңі
-
Термодинамиканың бірінші заңына сәйкес, жүйенің атқаратын жұмысы:
A=Q-∆U теңдеуі бойынша анықталады
-
Термодинамикалық функция –энтропия S:
Өлшем бірлігі – Дж/моль*К
-
Энтропияға S сәйкес келетін сипаттамаларды таңдаңыз:
Жүйенің бір күйден екінші күйге өту жолына байланысты емес, бірақ жүйенің бастапқы және соңғы күйімен анықталады
- Аммиактың түзілу энтальпиясы – 46,0 кДж/мольге тең.2NH3→N2+3H2 реакция нәтижесінде энтальпия өзгерісі тең болады:
1) +46,0 кДж/мольге
2) +92,0 кДж/мольге
-
-23,0 кДж/мольге -
-92,0 кДж/мольге -
+23,0 кДж/мольге
- 1 2 3 4 5 6 7 8 9 ... 12
Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
Жұмыс
-
Барлық элементтердің энтальпиясы стандартты жағдайда тең болады:
Нөлге тең
-
Экзотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
Тек қана теріс мәнде
-
Эндотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
Тек қана оң мәнде
-
Н2(г)+Сl2(г)=2НСl(г) +44ккал реакциясы үшін хлорсутектің түзілу энтальпиясы тең болады:
-22 ккал/моль.
- H2+J2=2HJ, ∆H=12,40ккал реакциясы үшін сутекті иодтың түзілу жылуын есептеңіз:
-6,20 ккал/моль
- С6Н6 +15/2О2→3Н2О+6СО2 реакциясының жылу эффектісі ∆Н=-3264,6 кДж/мольге тең. 7,8г бензол жанғанда бөлінетін жылуын есептеңіз:
-
3264,6 кДж/моль -
3,2646 кДж/моль -
32,646 кДж/моль -
326,46 кДж/моль -
32646 кДж/моль
-
-
Төменде келтірілгеннен эндотермиялық реакцияларды таңдаңыз:
СаСО3=СаО+СО2
-
Экзотермиялық реакцияларды көрсетіңіз:
С6Н6+15/2О2→3Н2О*6СО2
- Изобаралық жағдайда жүйенің ішкі энергиясы ∆U мен энтальпиясы ∆H арасындағы айырмашылық тең болады:
р∆V
-
Күшті электролитті таңдаңыз
HCl
-
При увеличении концентрации какого иона увеличиваются кислотные свойства раствора?-
H+ -
Na+ -
K+ -
OH- -
Cl-
-
-
Буферлік ерітінді дайындау үшін берілген заттардың қай жұбын алуға болады?-
КОН + КСl -
НСl + КСl -
Н2СО3 + NaНСО3 -
КСl + NаNО3
-
-
рН-ң қандай мәнінде бикарбонатты буферлік ерітінді дайындауға болады, егер рКа (H2CO3) = 6,35 тең болса?-
рН = 2 -
рН = 9 -
рН = 4 -
рН = 7 5) рН=12
-
-
Буферлік жүйетұрады
әлсіз қышқыл мен күшті негізден
-
Қан плазмасының мәні қалыпты жағдайда құрайды
7,4
-
Өкпенің шектен тыс жұмыс істеуі нәтижесінде қанның рН-ң мәні 7,5 құрады. Мұндай күй аталады-
респираторлы ацидоз -
метаболиттік алкалоз -
респираторлы алкалоз -
метаболиттік ацидоз
-
-
Фосфатты буферлі жүйеде әлсіз қышқылдың рөлін атқарады
ортофосфор қышқылы
-
Аммиакты буферлік жүйенің құрамына кіретін қосылыстар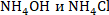
-
Сұйылтылған сулы ерітінділерді рН және рОН қосындысы нешеге тең болады?
14
-
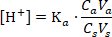 Ацетатты буферлік ерітіндіде сутек иондарының концентрациясын қандай теңдеу бойынша есептеуге болады?
Ацетатты буферлік ерітіндіде сутек иондарының концентрациясын қандай теңдеу бойынша есептеуге болады?
5)
-
Егер [Н+] =10-4 болса [ОН- ] концентрациясы нешеге тең болады?
