ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 159
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Определение железа (III) в растворе (рабочий электрод - стеклянный)
1. Уравнение титрования железа (III) раствором ЭДТА в молекулярном, полном и сокращенном ионном виде:
Fe3++ H2Y2-
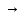 …
…
Факторы эквивалентности.
Закон эквивалентности.
Ход определения.
Результаты титрования железа (III) (ориентировочное титрование, рабочий электрод - стеклянный)
Таблица 12.16.
|
№ точки |
Объем раствора титранта V, см3 |
Значение pН |
Значение рН |
|
|
|
|
|
Результаты титрования железа (III) (точное титрование)
Таблица 12.17.
|
№ точки |
Объем раствора титранта V, см3 |
Значение pН |
Значение рН |
|
|
|
|
|
|
|
Построение кривых точного титрования
в координатах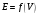 и
и
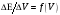 .
.
4. Расчёт результатов определения железа (III) и хлорида железа (III) (точность расчётов – 4 значащих цифры, для массы 0,0001 г). Привести расчётные формулы и расчёты, рассчитанные значения занести в таблицы 12.18.
Результаты определения модельной смеси железа (III) и хлорида железа (III)
Таблица 12.18.
|
с(1/1 Fe3+), моль/дм3 |
T(Fe3+), г/см3 |
n(1/1 Fe3+), моль |
ν(Fe3+), моль |
m(Fe3+), г |
|
|
|
|
|
|
|
с(1/1 FeCl3), моль/дм3 |
T(FeCl3), г/см3 |
n(1/1 FeCl3), моль |
ν(FeCl3), моль |
m(FeCl3), г |
|
|
|
|
|
|
5. Расчёт относительной погрешности:
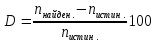
-
Вопросы для самоподготовки.
На чем основаны потенциометрические методы анализа?
Что представляют собою электроды I, II и III рода? Приведите примеры.
Какие функции выполняют индикаторные электроды и какие – электроды сравнения? Какие требования к ним предъявляются?
На каком принципе основана работа ионселективных электродов? Их классификация и принцип действия.
В чем сущность потенциометрического определения рН раствора? Какие индикаторные электроды могут быть использованы для определения рН?
Указать область применения, достоинства и недостатки прямой потенциометрии.
В чем сущность некомпенсационного метода потенциометрического титрования и титрования под током?
Чем обусловлен выбор пары электродов? Выбор координат для построения кривых титрования? Привести примеры с использованием различных типов реакций: нейтрализации, редоксиметрии, осаждения, комплексообразования.
Как найти точку эквивалентности при потенциометрическом титровании?
В чем достоинства и недостатки метода потенциометрического титрования? Назовите области его применения.
-
Кулонометрия
-
Цель и задачи работы
-
Изучение возможностей и аппаратурного оформления кулонометрии, овладение приемами практического применения кулонометрического титрования в амперостатическом режиме.
-
Реактивы и оборудование
1. Кулонометр Эксперт-006;
2. Магнитная мешалка;
3. Мерный цилиндр вместимостью 50 см3;
4. Градуированная пипетка вместимостью 10 cм3;
5. Ацетатный буферный раствор, рН=3,7;
6. Йодид калия 0,1 моль/дм3
7. Тиосульфат натрия 0,01 моль/дм3
8. Соляная кислота 10-2 моль/дм3
9. Сульфат калия, ω=10 %
-
Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
Определение тиосульфата натрия основано на электрогенерации I2 из I- на платиновом аноде и последующем взаимодействии титранта с определяемым веществом. Конечную точку титрования определяют потенциометрически.
Ход работы
-
Порядок работы на кулонометре Эксперт-006
Нажмите на лицевой панели кулонометра клавишу «ИЗМ».
Проводим предэлектролиз: на дисплее загорится сообщение «Установка в начало», прибор начнет пропускать через электролит ток (50 мА), до тех пор, пока потенциал, регистрируемый бипотенциометрической индикаторной системой, не достигнет уровня измерения.
На дисплее появится сообщение «Введите пробу».
Внесите в анодную камеру кулонометрической ячейки аликвоту раствора тиосульфата.
Зафиксировав скачок потенциала на индикаторной системе, прибор автоматически начнет перемешивание электролита в анодной камере ячейки, включится режим «Перемешивание».
Затем прибор в режиме «Измерение» оттитрует аликвоту внесенного тиосульфата и на дисплее появится сообщение «Результат измерения».
Списать с дисплея значение времени титрования tэ или значение количества электричества для дальнейшего расчета.
Рекомедуется операцию провести трижды и по трем измерениям установить среднее значение.
-
Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
Рис. 1. Схема лабораторной установки.
2. В анодное пространство ячейки внести 50 см3, а в катодное 2,5 см3 ацетатного буферного раствора рН=3,7.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см3) раствора тиосульфата натрия.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
-
Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
Определение кислот основано
на электрогенерации ионов
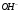 из
из
 на платиновом электроде и последующем
их взаимодействии с ионами
на платиновом электроде и последующем
их взаимодействии с ионами
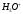 .
При этом на катоде протекают следующие
реакции:
.
При этом на катоде протекают следующие
реакции:
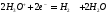
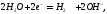
а в растворе:
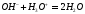
После завершения химической
реакции избыток ионов
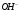 создает в растворе щелочную реакцию,
что обнаруживается визуально по изменению
окраски кислотно-основного индикатора
или потенциометрически (
создает в растворе щелочную реакцию,
что обнаруживается визуально по изменению
окраски кислотно-основного индикатора
или потенциометрически (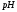 -метрически)
со стеклянным индикаторным электродом.
Для повышения электропроводности в
исследуемый раствор добавляют
индифферентный сильный электролит.
-метрически)
со стеклянным индикаторным электродом.
Для повышения электропроводности в
исследуемый раствор добавляют
индифферентный сильный электролит.
Ход работы
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
другая
Рис. 1. Схема лабораторной установки.
2. В катодное пространство ячейки помещают 25 см3 раствора сульфата калия и доводят объем раствора до 50 см3 дистиллированной водой. В анодную камеру вносят 2,5 см3 раствором сульфата калия.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см3) раствора соляной кислоты.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
-
Оформление лабораторного журнала
-
Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
-
1. Цели и задачи работы
2. Ход работы
3. Написать уравнения реакции анодного окисления йодид-ионов с образованием элементарного йода и реакцию окисления тиосульфата натрия йодом в кислой среде. Для обеих реакций привести полное, ионное сокращенное уравнения. Написать окислительно-восстановительные процессы.
4. Привести график зависимости потенциала от времени.
5. Внести результаты измерения в Таблицу 1. и рассчитать среднее время титрования с доверительным интервалом для каждой из аликвот, массу тиосульфата натрия с помощью закона Фарадея.
Результаты определения тиосульфата натрия
Таблица 1.
|
№ |
Объем пробы, мл |
Время титрования, сек |
Среднее время титрования, сек |
Масса тиосульфата, мг |
Среднее значение, мг |
|
1 |
1 |
|
|
|
|
|
2 |
|
|
|||
|
3 |
|
|
|||
|
4 |
2 |
|
|
|
|
|
5 |
|
|
|||
|
6 |
|
|

 см-3
см-3