ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 126
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
Рассчитывают относительную погрешность определения Cu2+ по массе
D=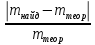 ∙100%
∙100%
3.5. Определение меди(II) в водных растворах дифференциальным методом.
Ход определения.
Построить график дифференциальным методом в координатах
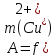 и
и
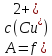 .
.
Пользуясь графиком, находят содержание меди в анализируемом растворе.
Определить концентрацию и массу меди(II) в контрольной задаче.
Результаты определения для меди(II).
Таблица 9.2.1.5.
|
с(Cu2+), моль/дм3 |
T(Cu2+), мг/см3 |
ν(Cu2+),моль |
m(Cu2+),мг |
D, % |
|
|
|
|
|
|
|
с(CuSO4), моль/дм3 |
T(CuSO4), мг/см3 |
ν(CuSO4),моль |
m(CuSO4),мг |
|
|
|
|
|
|
Рассчитать относительную погрешность определения Cu2+
3.6. Сравнение определений меди (II) по методу градуировочного графика и дифференциальным методом.

-
Определение железа (III) в водных растворах методом градуировочного графика.
1. Цель и задачи работы.
2. Уравнение фотометрической реакции.
3. Ход определения.
3.1. Ход приготовления серии стандартных растворов.
3.2. Ход приготовления раствора сравнения.
3.3. Выбор светофильтра.
Данные для построения спектральной характеристики железа (III).
Таблица 9.2.1.1
|
№ светофильтра |
λ, нм |
Оптическая плотность |
|
|
|
|
Строят спектральную характеристику
раствора в координатах .
Делают вывод о выборе рабочей длины
волны.
.
Делают вывод о выборе рабочей длины
волны.
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
Данные для построения градуировочных зависимостей.
Таблица 9.2.1.2.
|
№ стандартного раствора |
m (Fe), мг |
Концентрация Fe, моль/дм3 |
Оптическая плотность (А) относительно раствора сравнения (градуировочный график) |
|
|
КФК-2 (l=2,0 см) |
ЭКСПЕРТ-003 (l=1,0 см) |
|||
|
1 |
0,1 |
|
|
|
|
|
|
|||
|
|
|
|||
|
2 |
0,2 |
|
|
|
|
|
|
|||
|
|
|
|||
|
3 |
0,3 |
|
|
|
|
|
|
|||
|
|
|
|||
|
4 |
0,4 |
|
|
|
|
|
|
|||
|
|
|
|||
|
5 |
0,5 |
|
|
|
|
|
|
|||
|
|
|
|||
|
6 |
0,6 |
|
|
|
|
|
|
|||
|
|
|
|||
|
Контрольный раствор |
|
|
|
|
|
|
|
|||
|
|
|
|||
Для расчета молярного коэффициента поглощения строят градуировочный график в координатах А=f(c(Fe3+). C помощью компьютерных программ Microsoft Excel или Sigmaplot определяют параметры линейной регрессии (таблица 9.2.1.3).
Параметры линейной регрессии А=f(c(Fe3+).
Таблица 9.2.1.3.
|
Прибор |
l, см |
|
|
a±Δа |
b±Δb |
R |
ε±Δε |
|
КФК-2 |
2,0 |
|
|
|
|
|
|
|
Эксперт-003 |
1,0 |
|
|
|
|
|
|
Рассчитывают молярный коэффициент поглощения ε при рабочей длине волны, сравнивают с литературными данными.
Рассчитать относительную погрешность определения Fe3+ по молярному коэффициенту поглощения света.
D=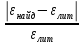 ∙100%
∙100%
Делают обоснованный вывод о точности определения содержания железа в анализируемом растворе по методу градуировочного графика.
Для определения содержания железа строят графики зависимости в координатах A=f(m(Fe3+) методом градуировочного графика.
Рассчитывают концентрацию и содержание железа в анализируемом растворе. Результаты заносят в таблицу 9.2.1.4.
Результаты определения для железа (III).
Таблица 9.2.1.4.
|
с(Fe3+), моль/дм3 |
T(Fe3+), мг/см3 |
ν(Fe3+),моль |
m(Fe3+),мг |
D, % |
|
|
|
|
|
|
|
с(Fe(NH)4(SO4)2), моль/дм3 |
T(Fe(NH)4(SO4)2), мг/см3 |
ν(Fe(NH)4(SO4)2), моль |
m(Fe(NH)4(SO4)2), мг |
|
|
|
|
|
|
Рассчитывают относительную погрешность определения Fe3+ по массе
D=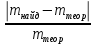 ∙100%
∙100%
-
Определение титана (IV) методом градуировочного графика.
1. Цель и задачи работы.
2. Уравнение фотометрической реакции.
3. Ход определения.
3.1. Ход приготовления серии стандартных растворов.
3.2. Ход приготовления раствора сравнения.
Ход определения.
3.3. Определение титана (IV) методом градуировочного графика.
Данные для построения градуировочных зависимостей.
Таблица 9.2.1.2.
|
№ стандартного раствора |
m (Ti), мг |
Концентрация Ti, моль/дм3 |
Оптическая плотность (А) относительно раствора сравнения (градуировочный график) |
|
|
КФК-2 (l=2,0 см) |
ЭКСПЕРТ-003 (l=1,0 см) |
|||
|
1 |
0,5 |
|
|
|
|
|
|
|||
|
|
|
|||
|
2 |
1,0 |
|
|
|
|
|
|
|||
|
|
|
|||
|
3 |
1,5 |
|
|
|
|
|
|
|||
|
|
|
|||
|
4 |
2,0 |
|
|
|
|
|
|
|||
|
|
|
|||
|
5 |
2,5 |
|
|
|
|
|
|
|||
|
|
|
|||
|
Контрольный раствор |
|
|
|
|
|
|
|
|||
|
|
|
|||