ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 155
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Вопросы для самоподготовки
-
На чём основан рефрактометрический метод анализа?
-
Что называется относительным показателем преломления?
-
Что называется абсолютным показателем преломления?
-
От каких факторов зависит показатель преломления?
-
Что называется дисперсией света и как она влияет на показатель преломления?
-
Какой луч называется предельным?
-
На чём основано устройство рефрактометра?
-
Какое явление называется полным внутренним отражением и как оно используется в рефрактометре?
-
Какова оптическая схема рефрактометра?
-
Каковы пределы измерения показателя преломления на рефрактометрах?
-
Какова погрешность измерений (%) на рефрактометре?
-
Поляриметрия
-
Цель и задачи работы
-
Изучение работы поляриметра, овладение навыками практического применения поляриметрического метода анализа.
-
Оборудование и реактивы
-
Поляриметр СМ-3;
-
Рабочий раствор глюкозы ω(C6H12O6) = 20%;
-
Мерная пробирка вместимостью 10 см3 – 6 шт.
-
Рабочий раствор сорбита ω(C6H14O6) = 20%;
-
Молибдат аммония (NH4)6Mo7O24·4H2O криталлический, ч.д.а.;
-
Серная кислота, раствор С(1/2 H2SO4) = 0,5 моль/дм3.
-
Аналитические весы;
-
Мерные колбы вместимостью 100,0 см3 – 2 шт.;
-
Пипетка Мора 10,0 см3.
-
Поляриметрическое определение глюкозы
Поляриметрический метод анализа основан на зависимости угла вращения плоскости поляризации плоскополяризованного света от концентрации оптически активного вещества в растворе.
Для поляриметрических определений используют прозрачные растворы.
Ход работы:
-
Приготовление стандартных растворов глюкозы:
-
Разбавлением рабочего раствора глюкозы готовят серию стандартных растворов с содержанием глюкозы 3; 6; 9; 12 (%).
-
Необходимые объемы исходного раствора и воды находят графическим методом (креста). Например, для приготовления первого раствора:
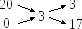
т.е. на 3 весовых частей исходного раствора необходимо взять 17 весовых частей воды. Переходя к объемам и учитывая, что воды = 1 г/см3, находят объем исходного раствора (необходимый для приготовления 25 см3 первого стандартного раствора) из соотношения:
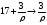
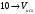
где
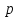 - плотность исходного раствора (
- плотность исходного раствора (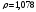 ).
).
-
Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
-
Построение градировочного графика
Каждый раствор вносят в кювету и измеряют угол вращения с помощью поляриметра 5-7 раз.
Результаты измерений вносят в таблицу 5.1.
Строят градуировочный график в координатах
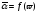 .
.
2. Контрольная задача
Анализируемую пробу довести до метки дистиллированной водой.
Контрольный раствор вносят в кювету и измеряют угол вращения с помощью поляриметра 5-7 раз.
Результаты измерений вносят в таблицу 5.1.
По графику находят
 .
.
-
Поляриметрическое определение сорбита в смеси.
Методика основана на измерении оптической
активности сорбита с добавлением
молибдата аммония и без него. Удельное
вращение
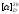 сорбита мало (-2,01°); в присутствии
молибдата аммония образуется комплексное
соединение, удельное вращение которого
+105,6°.
сорбита мало (-2,01°); в присутствии
молибдата аммония образуется комплексное
соединение, удельное вращение которого
+105,6°.
Ход работы:
2.2.1. Определение сорбита в контрольной пробе.
В мерную колбу вместимостью 100,0 см3 вносят с помощью пипетки по 10,0 см3 анализируемый раствор, объем раствора доводят до метки дистиллированной водой, перемешивают и измеряют угол вращения с помощью поляриметра 5-7 раз.
В другую мерную колбу вместимостью 100,0 см3 с помощью пипетки по 10,0 см3 вносят анализируемый раствор, прибавляют 1,000 г молибдата аммония и с помощью цилиндра по 25,0 см3 вносят раствор серной кислоты. После полного растворения молибдата аммония объем раствора доводят до метки дистиллированной водой и измеряют угол вращения с помощью поляриметра 5-7 раз.
-
Оформление лабораторного журнала
-
Определение глюкозы
-
-
Цель и задачи работы
-
Ход работы. Приготовление стандартных растворов глюкозы
-
Расчет аликвот исходного раствора по правилу креста.
-
Ход работы. Определение содержания глюкозы в анализируемом растворе.
-
Данные для построения градуировочного графика.
Холостой опыт α0=…
Таблица 1.
|
|
|
|
|
3 |
|
|
|
6 |
|
|
|
9 |
|
|
|
12 |
|
|
|
К |
|
|
-
Градуировочный график.
-
Определение массовой доли контрольного раствора.
-
Определение аликвоты исходного раствора для приготовления контрольного раствора.
-
Расчет относительной погрешности D, %.
-
Определение сорбита
-
Цель работы
-
Ход работы
-
Определение массы сорбита (mсорб) по формуле:
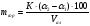
Где α2 — показание поляриметра при добавлении (NH4)6Mo7O24·4H2O;
α1— показание поляриметра для водного раствора;
Vал — объем анализируемого раствора , взятый для испытания, см3;
К — коэффициент пересчета по ГОСТ 29206-91 (К = 0,167).
-
Относительное стандартное отклонение параллельных измерений не должно превышать 0,6%.
-
Доверительный интервал для найденного среднего ±2.
-
Вопросы для самоконтроля
-
Кондуктометрия.
-
Цель и задачи работы.
-
Изучение возможностей и аппаратурного оформления кондуктометрии, овладение приемами практического применения кондуктометрического титрования.
-
Оборудование и реактивы
1. Кондуктометр КП – 001.
2. Магнитная мешалка.
3. Стакан объемом 250 см3.
4. Мерная колба объемом 100 см3.
5. Бюретка объемом 25 см3.
6. Пипетка объемом 10 см3.
7. Гидроксид натрия, раствор
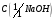 = 0,1 моль/дм3.
= 0,1 моль/дм3.
8. Борная кислота, раствор
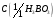 = 1 моль/дм3.
= 1 моль/дм3.
9. Гидрохлорид гидроксиламина, раствор
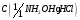 = 1 моль/дм3 .
= 1 моль/дм3 .
10. Этилендиаминтетрацетат натрия,
раствор
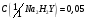 моль/дм3.
моль/дм3.
11. Хлорид никеля, раствор
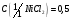 моль/дм3.
моль/дм3.
12. Хлорид кальция, раствор
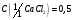 моль/дм3 .
моль/дм3 .
13. Сульфат натрия, раствор (С1/1 Na2SO4) = 1моль/дм3.
14. Хлорид бария, раствор (С1/1 BaCl2) = 0,1моль/дм3.
15. Стакан вместимостью 250 см3.
16. Мерная колба вместимостью 250 см3 – 7 шт.
17. Колонка (диаметр 15мм, длина 300 мм), содержащая 10 г катионообменни-ка КУ-1 в Н – форме.
18. Хлороводородная кислота, раствор С(1/1НСl)= 0,001 моль/дм3.
19. Хлорид натрия, раствор Т (NaCl) =5,86 мг/см3.
20. Пипетка вместимостью 2 см3.
21. Мерный цилиндр вместимостью 200 см3.
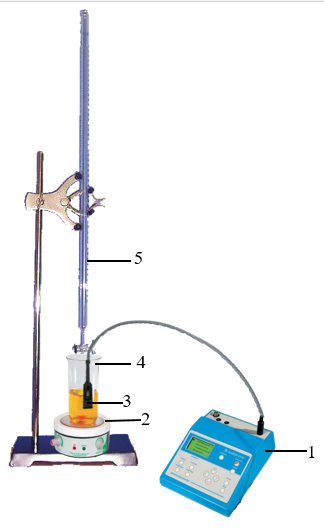
Рис. 14.1. Установка для кондуктометрического титрования:
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Определение солесодержания вод скважин методом прямой кондуктометрии.
Определение солесодержания основано на кондуктометрическом определении концентрации протонов, выделившихся при пропускании солесодержащих вод через катионообменную колонку.
Ход работы
1. Построение градуировочного графика.
Для этого в мерные колбы вместимостью 250 см3 вносят рассчитанный объем рабочего раствора для приготовления серии стандартных растворов с концентрациями 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3.
К 200 см3 каждого стандартного раствора добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменный сорбент.
Полученный раствор помещают в стакан и опускают в него кондуктометрический датчик и измеряют значение удельной электропроводности растворов. Полученные результаты заносят в таблицу 14.2.
Строят график зависимости удельной электропроводности (æ, См/см) от солесодержания (мг/дм3).
2. Контрольная задача. Определение солесодержания испытуемого образца воды
К 200 см3 испытуемого образца воды добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
Измеряют удельную электропроводность полученного раствора и значение заносят в таблицу 14.2.
Находят солесодержание контрольного раствора по градуировочному графику и рассчитывают солесодердание с учетом погрешности датчика.


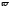 ,
%
,
% ,
0
,
0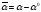 ,
0
,
0