ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 157
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Тульский государственный университет»
Кафедра химии
Сборник методических указаний к лабораторным работам
по дисциплине
«Аналитическая химия»
Направление подготовки: 020100 «Химия»
Профиль подготовки (специализация): 020100.62.10. «Химия окружающей среды,
химическая экспертиза и экологическая безопасность»
Форма обучения: очная
Тула 2018 г.
1 Атомно-эмиссионная фотометрия пламени 10
1.1 Цель и задачи работы 10
1.2 Оборудование и реактивы 10
1.3 Программа работы 10
1.3.1 Определение калия по методу градуировочного графика 10
1.3.2 Определение натрия по методу градуировочного графика 13
1.3.3 Определение кальция по методу градуировочного графика 13
1.4 Оформление лабораторного журнала. 14
1.4.1 Определение содержания калия в анализируемом растворе. 14
1.4.2 Определение содержания натрия в анализируемом растворе. 15
1.4.3 Определения содержания кальция в анализируемом растворе. 17
1.5 Вопросы для самоконтроля 18
2 ИК-спектроскопия органических веществ 20
3 Фотометрический анализ 27
3.1 Цель и задачи работы 27
3.2 Оборудование и реактивы 27
3.2.1 Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика 29
3.2.2 Определение железа (III) методом градуировочного графика 31
3.2.3 Определение титана (IV) методом градуировочного графика 32
3.2.4 Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика 34
3.2.5 Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты 35
3.2.6 Определение нитрит-ионов 37
3.3 Оформление лабораторного журнала. 38
3.3.1 Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом. 38
3.3.2 Определение железа (III) в водных растворах методом градуировочного графика. 42
3.3.1 Определение титана (IV) методом градуировочного графика. 44
3.3.2 Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика 47
3.3.3 Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты 50
3.3.4 Определение нитрит-ионов методом градуировочного графика. 52
3.4 Вопросы для самоконтроля 55
4 Фототурбидиметрия. 57
4.1 Цель и задачи работы 57
4.2 Оборудование и реактивы 57
4.2.1 Определение сульфатов в растворе 57
4.2.2 Клетки 59
4.3 Оформление лабораторного журнала. 59
4.3.1 Определение сульфатов турбидиметрическим методом. 59
4.3.2 клетки 61
4.4 Вопросы для самоконтроля 61
5 Рефрактометрия 62
5.1 Цель и задачи работы 62
5.2 Оборудование и реактивы 62
5.3 Программа работы 62
5.3.1 Рефрактометрическое определение сахара в молоке. 62
5.3.2 Определение содержания хлорида натрия в водном растворе. 65
5.4 Оформление лабораторного журнала 67
5.5 Вопросы для самоподготовки 69
6 Поляриметрия 71
6.1 Цель и задачи работы 71
6.2 Оборудование и реактивы 71
6.2.1 Поляриметрическое определение глюкозы 71
6.2.2 Поляриметрическое определение сорбита в смеси. 72
6.3 Оформление лабораторного журнала 73
6.3.1 Определение глюкозы 73
6.3.2 Определение сорбита 74
6.4 Вопросы для самоконтроля 74
7 Кондуктометрия. 75
7.1 Цель и задачи работы. 75
7.2 Оборудование и реактивы 75
7.2.1 Определение солесодержания вод скважин методом прямой кондуктометрии. 76
7.2.2 Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии 77
7.2.3 Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования 78
7.2.4 Определение слабой кислоты и соли слабого основания в их смеси. 78
7.2.5 Определение
ионов
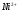 и
и
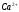 в их смеси методом кондуктометрического
титрования 80
в их смеси методом кондуктометрического
титрования 80
7.2.6 Определение сульфат-ионов методом кондуктометрического титрования 82
7.3 Оформление лабораторного журнала 83
7.3.1 Определение солесодержания вод скважин методом прямой кондуктометрии 83
7.3.2 Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии 84
7.3.3 Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования 84
7.3.4 Определение
ионов
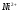 и
и
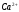 в их смеси методом кондуктометрического
титрования 86
в их смеси методом кондуктометрического
титрования 86
7.3.5 Определение сульфат ионов методом кондуктометрического титрования 88
7.4 Вопросы для самоконтроля. 89
8 Потенциометрия 91
8.1 Цель и задачи работы 91
8.2 Оборудование и реактивы 91
8.2.1 Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок 93
8.2.2 Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования 95
8.2.3 Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования 97
8.2.4 Определение железа (II) в присутствии железа (III) методом потенциометрического титрования. 99
8.2.5 Определение свинца (II) в растворе. 100
8.2.6 Определение железа (III) в растворе 101
8.3 Оформление лабораторного журнала 103
8.3.1 Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок 103
8.3.2 Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования 108
8.3.3 Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования 110
8.3.4 Определение железа (II) в присутствии железа (III) методом потенциометрического титровании. 113
8.3.5 Определение железа (III) в растворе 115
8.4 Вопросы для самоподготовки. 117
9 Кулонометрия 119
9.1 Цель и задачи работы 119
9.2 Реактивы и оборудование 119
9.2.1 Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности 119
9.2.2 Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности 121
9.3 Оформление лабораторного журнала 122
9.3.1 Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности 122
9.3.2 Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности. 124
9.4 Вопросы для самоподготовки 125
-
Атомно-эмиссионная фотометрия пламени
-
Цель и задачи работы
-
Изучение принципа и режимов работы пламенного фотометра, овладение навыками практического применения пламенно-фотометрического метода анализа, методикой построения градуировочных графиков и расчетами определения элементов градуировочных графиков, методом ограничивающих растворов, методом добавок и методом трёх эталонов.
-
Оборудование и реактивы
Пламенный фотометр - ПФМ;
Компрессор;
Рабочие растворы хлорида калия, хлорида
натрия с концентрацией в пересчёте на
калий, натрий 100 мкг/см3 и хлорида
кальция с концентрацией в пересчёте на
кальций 500 мкг/см3. Навески
квалификации х.ч.
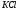 (0,019 г),
(0,019 г),
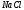 (0,0254 г) и
(0,0254 г) и
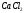 (0,1390 г) вносят в мерные колбы объемом
100 см3, доводят растворы до метки
дистиллированной водой и тщательно
перемешивают;
(0,1390 г) вносят в мерные колбы объемом
100 см3, доводят растворы до метки
дистиллированной водой и тщательно
перемешивают;
Мерные колбы объемом 100 см3, 7шт;
Градуированная пипетка объемом 10 см3, 1шт;
Мерные пробирки объемом 25 см3, 7шт.
-
Программа работы
-
Определение калия по методу градуировочного графика
-
Метод определения калия
основан на фотометрировании дублетов
спектральных линий калия
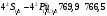 нм излучаемых в низкотемпературном
(пропан — воздух) пламени.
нм излучаемых в низкотемпературном
(пропан — воздух) пламени.
Ход работы.
-
Приготовление стандартных растворов:
Из исходного раствора, содержащего 100 мкг/см3 калия, готовят 6 стандартных растворов с концентрацией калия (натрия, кальция) 1,0; 2,0; 4,0; 6,0; 8,0; 10,0 мкг/см3.
Для этого 1,0; 2,0; 4,0; 6,0; 8,0 и 10,0 см3 исходного раствора хлорида калия (натрия, кальция) вводят в мерные колбы объемом 100 см3, доводят объём каждого раствора до 100 см3 дистиллированной водой и тщательно перемешивают.
-
Подготовка прибора к работе:
Включить сетевой шнур фотометра и компрессора в электрическую сеть;
Ручкой “ВОЗДУХ” установить подачу воздуха. Значение давления воздуха должно быть в пределах от 50 — 70 кПа;
Затем ручкой “Газ” осуществить подачу газа.
Электрозажигалкой поджечь пламя. Наблюдая в смотровое окно, регулировать пламя, так чтобы восстановительный конус пламени был резко очерчен, имел минимальную высоту (3-4 мм) и окрашен в зеленовато-голубой цвет, при этом пламя не должно отрываться от насадка и не должно быть турбулентным.

