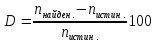ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 154
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
7. Титрование повторяют 3 раза.
8. По результатам титрования строят
кривые титрования в координатах
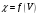 .
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
.
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
9. Находят средний объем раствора, израсходованного на титрование.
10. Рассчитывают содержание и концентрацию сульфат ионов по известным формулам.
-
Оформление лабораторного журнала
-
Определение солесодержания вод скважин методом прямой кондуктометрии
-
1. Цель и задачи работы.
2. Ход работы.
Построение градуировочного графика
Данные для построения градуировочного графика.
Таблица 1.3.1.
|
№ стандарта |
Солесодержание, мг/дм3
|
Удельная электропроводность æ1, См/см |
Удельная электропроводность æ2, См/см |
Удельная электропроводность æ3, См/см |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
Контрольный |
|
|
|
|
C помощью компьютерных программ Microsoft Excel или Sigmaplot определяют параметры линейной регрессии (таблица 1.3.2.).
Таблица 1.3.2.
|
Прибор |
Sa |
Sb |
a±∆a |
b±∆b |
R |
|
|
|
|
|
|
|
По градуировочному графику рассчитать солесодержание в анализируемом образце.
С учетом погрешности кондуктометрического датчика рассчитать солесодержание (S) по формуле:
S=(К·1,0220-t·æ)-0,58,
где K- коэффициент датчика, определяемый как отношение солесодержания к удельной электропроводности в любой точке графика;
t – температура пробы, оС;
æ - удельная электропроводность, См/см.
0,58 – это коэффициент
-
Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
1. Цель и задачи работы.
2. Ход работы.
3. Результаты исследования образцов.
Данные исследования степени очистки воды.
Таблица 1.3.1.
|
Номер образца |
Значение удельной электропроводности æi, См/см |
Среднее значение удельной электропроводности æ, См/см |
Вывод о степени чистоты |
||||
|
|
|
|
|||||
|
|
|
|
|
|
|
||
-
Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
1. Цель и задачи работы
2. Уравнение реакции стандартизации NaOH в молекулярном, полном и сокращенном ионном виде:
HCl + NaOH
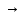 …
…
Факторы эквивалентности.
Законы эквивалентности.
Ход стандартизации.
Результаты стандартизации раствора NaOH
Таблица 14.2.
|
№ точки |
Объем раствора титранта V, см3 |
Удельная электропроводность æ1, См/см |
Удельная электропроводность æ2, См/см |
Удельная электропроводность æ3, См/см |
|
|
|
|
|
|
Построение кривых титрования в
координатах
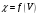 .
Апроксимация зависимости
уравнением линейной регрессии и
нахождение объема титранта в точки
эквивалентности.
.
Апроксимация зависимости
уравнением линейной регрессии и
нахождение объема титранта в точки
эквивалентности.
Расчёт с(1/1 NaOH) и Т (NaOH).
3. Уравнения титрования модельной смеси борной кислоты и солянокислого гидроксиламина в молекулярном, полном и сокращенной ионном виде:
H3BO3+
NaOH …
…
NH2OH·HCl+
NaOH …
…
Факторы эквивалентности.
Законы эквивалентности.
Ход работы.
Результаты титрования модельной смеси борной кислоты и солянокислого гидроксиламина в водном растворе
Таблица 14.3.
|
№ точки |
Объем раствора титранта ,V см3 |
Удельная электропроводность æ1, См/см |
Удельная электропроводность æ2, См/см |
Удельная электропроводность æ3, См/см |
|
|
|
` |
|
|
Построение кривых титрования в
координатах
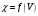 .
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
.
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
4. Расчёт результатов определения борной кислоты и солянокислого гидроксиламина (точность расчётов – 4 значащих цифры, для массы 0,0001 г). Привести расчётные формулы и расчёты, рассчитанные значения занести в таблицы 14.6.
Результаты определения модельной смеси борной кислоты и солянокислого гидроксиламина
Таблица 14.6.
|
с(1/1 H3BO3), моль/дм3 |
T(H3BO3), г/см3 |
n(1/1 H3BO3), моль |
ν(H3BO3), моль |
m(H3BO3), г |
|
|
|
|
|
|
|
с(1/1 NH2OH·HCl), моль/дм3 |
T(NH2OH·HCl), г/см3 |
n(1/1 NH2OH·HCl), моль |
ν(NH2OH· HCl), моль |
m(NH2OH·HCl), г |
|
|
|
|
|
|
5. Расчёт относительной погрешности: