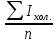ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 128
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
Рассчитать относительную погрешность определения Na+ по массе.
D =
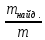 · 100%
· 100%
Рассчитывают концентрацию и содержание натрия в анализируемом растворе. Результаты заносят в таблицу 1.3.2.4.
Результаты определения для натрия.
Таблица 1.3.2.4.
|
с(Na+),моль/дм3 |
Т(Na+),мг/см3 |
ν(Na+),моль |
m (Na+),мг |
D,% |
|
|
|
|
|
|
|
с(NaCl),моль/дм3 |
Т(NaСl),мг/см3 |
ν(NaСl),моль |
m (NaCl),мг |
|
|
|
|
|
|
-
Определения содержания кальция в анализируемом растворе.
1. Цель и задачи работы.
2. Уравнение реакции.
3. Ход определения.
Данные для построения градуировочного графика.
Таблица 1.3.3.1.
|
№ стандартного раствора |
Концентрация, мкг/см3 |
Показания микроамперметра, мкА |
||
|
Ii,мкА |
Icp,мкА |
I=Icp-I0 |
||
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
Контрольный р-р |
|
|
|
|
Результаты холостого опыта.
Таблица 1.3.3.2.
|
I0,мкА |
|
|
I0cp
=
|
|
C помощью компьютерных программ Microsoft Excel или Sigmaplot определяют параметры линейной регрессии ( таблица 1.3.3.3.)
Параметры линейной регрессии А= f(c(Сa2+).
Таблица 1.3.3.3.
|
Прибор |
Sa |
Sb |
a±∆a |
b±∆b |
R |
|
Атомник |
|
|
|
|
|
Рассчитать относительную погрешность определения Сa2+ по массе.
D =
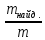 · 100%
· 100%
Рассчитывают концентрацию и содержание кальция в анализируемом растворе. Результаты заносят в таблицу 1.3.3.4.
Результаты определения для кальция.
Таблица 1.3.3.4.
|
с(Сa2+),моль/дм3 |
Т(Сa2+),мг/см3 |
ν(Сa2+),моль |
m (Сa2+),мг |
D,% |
|
|
|
|
|
|
|
с(СaCl2),моль/дм3 |
Т(СaСl2),мг/см3 |
ν(СaСl2),моль |
m (СaCl2),мг |
|
|
|
|
|
|
-
Вопросы для самоконтроля
-
Какова природа происхождения атомных спектров?
На использовании какого явления основана пламенная фотометрия?
На измерении каких величин осуществляется качественный и количественный анализ в атомных спектральных методах?
Что определяется термином «потенциал возбуждения». Как он соотносится с интенсивностью спектральной линии?
Приведите эмпирическую зависимость интенсивности излучения от концентрации определяемого компонента.
Какие процессы происходят с веществами в пламени катализатора?
В чём заключается явление самопоглощения? Как оно влияет на проведение анализа?
Приведите принципиальную схему прибора для атомно-эмиссионной спектроскопии (АЭС).
Какие отличия имеет пламенный фотометр от приборов АЭС? Покажите на принципиальной схеме.
Каково назначение основных узлов пламенного фотометра?
Какие элементы и почему можно анализировать методами АЭС и пламенной фотометрии?
Какие преимущества и недостатки имеет пламенная фотометрия перед АЭС?
В чём заключаются методы определения элементов АЭС: - градуировочного графика; - трёх эталонов; - добавок; - ограничивающих растворов?
Каковы основные характеристики атомно-эмиссионного метода анализа?
-
ИК-спектроскопия органических веществ
Сущность и основы метода ик-спектроскопии
Инфракрасный спектр химического соединения является одной из его наиболее важных характеристик.
Как известно, при инфракрасной спектроскопии в диапазоне каждой химической группировке органической молекулы соответствует определенный набор полос поглощения, которые хорошо изучены и приведены в соответствующих справочниках. Инфракрасная область спектра занимает диапазон длин волн от границы видимой до микроволновой области .то есть от 0,75 мк до 200 мк. Однако обычно под инфракрасной областью подразумевают более узкий интервал от 2,5 до 26 мк.
Спектры в этих областях содержат ценную информацию о строении соединений, но они еще недостаточно хорошо изучены даже для качественного применения. Для характеристики инфракрасного излучения обычно используют волновые числа, то есть величины, обратные длинам волн, измеренным в сантиметрах. Единицей волнового числа является обратный сантиметр (см-1). Так, интервал 2,5-16 мк соответствует интервалу 4000-625 см-1.
Движение химически связанных атомов напоминает непрерывное колебание системы шариков, связанных пружинами. Их движение можно рассматривать как результат наложения двух колебаний - растягивающего и изгибающего. Частоты колебаний зависят не только от самой природы отдельных связей, таких, как С-Н или С-О, но и от всей молекулы и ее окружения. Амплитуды колебаний связей и вместе с ними колебаний электрических зарядов увеличиваются, когда на них воздействуют электромагнитные волны (инфракрасные лучи).
Молекулой поглощаются только те частоты инфракрасного излучения, энергия которых точно соответствует разностям между двумя уровнями энергии связи. Амплитуда данного колебания, следовательно, возрастает не постепенно, а скачком. Значит, при облучении образца инфракрасным светом с непрерывно меняющейся частотой определенные участки спектра излучения должны поглощаться молекулой, вызывая растяжение или изгиб соответствующих связей. Луч, проходящий через вещество, ослабляется в области поглощения. Регистрируя интенсивность прошедшего излучения в зависимости от волновых чисел или длин волн, получают кривую, на которой видны полосы поглощения. Это и есть инфракрасный спектр.
Некоторые связи имеют характерные свойства: кратные связи сильнее одинарных, а связи типа X-Н (N-Н, О-Н, С-Н и т.д.) имеют очень легкий концевой атом водорода.Валентные колебания этих специфических связей лежат в области частот,характерной для соответствующего типа связей (рис.1.)
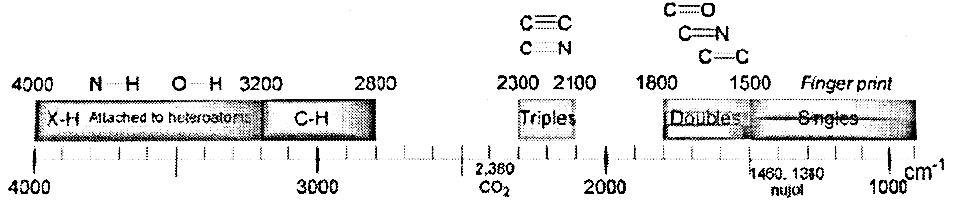
Рис.1. Области расположения полос поглощения характеристических групп
В области ниже 1600 см-1 проявляются полосы поглощения, обусловленные растяжением одинарных связей (С-С, С-N, С-О, С-галоген и т.д.), а также деформацией угла между связями. Силы всех одинарных связей приблизительно одного порядка, и, кроме того, они обычно соединены кумулятивно, например С-С-С-О. Это приводит к более сильному взаимодействию между связями, расширению области появления соответствующих полос поглощения и большой чувствительности положения полос даже к небольшим изменениям структуры.
Низкочастотная область инфракрасного спектра (1300-650 см-1) известна как область «отпечатков пальцев» - каждое соединение имеет в этом интервале свою специфическую спектральную кривую. Инфракрасная спектроскопия, таким образом, позволяет более эффективно идентифицировать соединения, чем стандартный метод измерения точки плавления.
Положение полосы определяется силой связи и массой связываемых атомов. Чем сильнее связь и чем меньше массы атомов, тем выше частота поглощения данной связи, то есть тем больше энергии нужно затратить на колебание связи. Так, например, сила связи возрастает при переходе от одинарной к двойной и тройной связям, и, соответственно, возрастают частоты валентных колебаний от 700-1500 до 1600-1800 и до 2000- 2500 см-1.
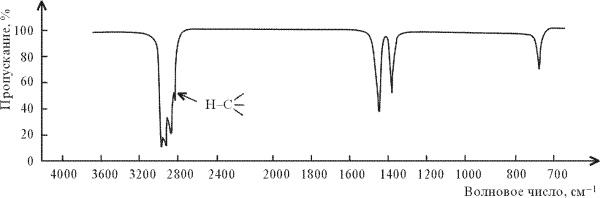 Рис.2.
ИК-спектр н-гексана СН3(СН2)СН3
Рис.2.
ИК-спектр н-гексана СН3(СН2)СН3
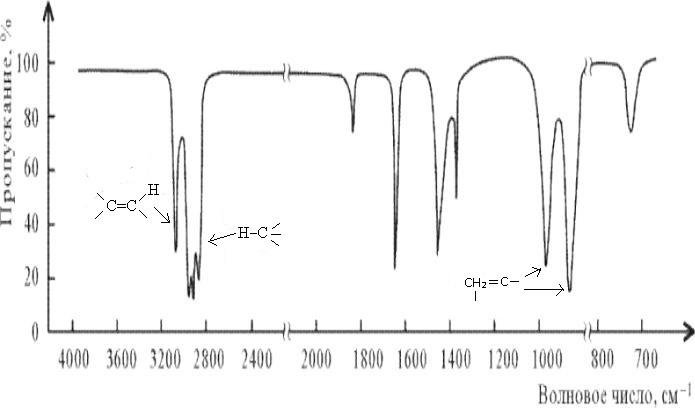 Рис.3.
ИК-спектр гексана-1 СН2=СН(СН2)3СН3
Рис.3.
ИК-спектр гексана-1 СН2=СН(СН2)3СН3
Частота валентного колебания С=О проявляется в области 2000-1500 см-1 и очень чувствительна к изменениям структуры молекулы и ее окружению, а поэтому информация о поглощении карбонильной группы оказывается чрезвычайно полезной при исследовании органических соединений (рис. 4).
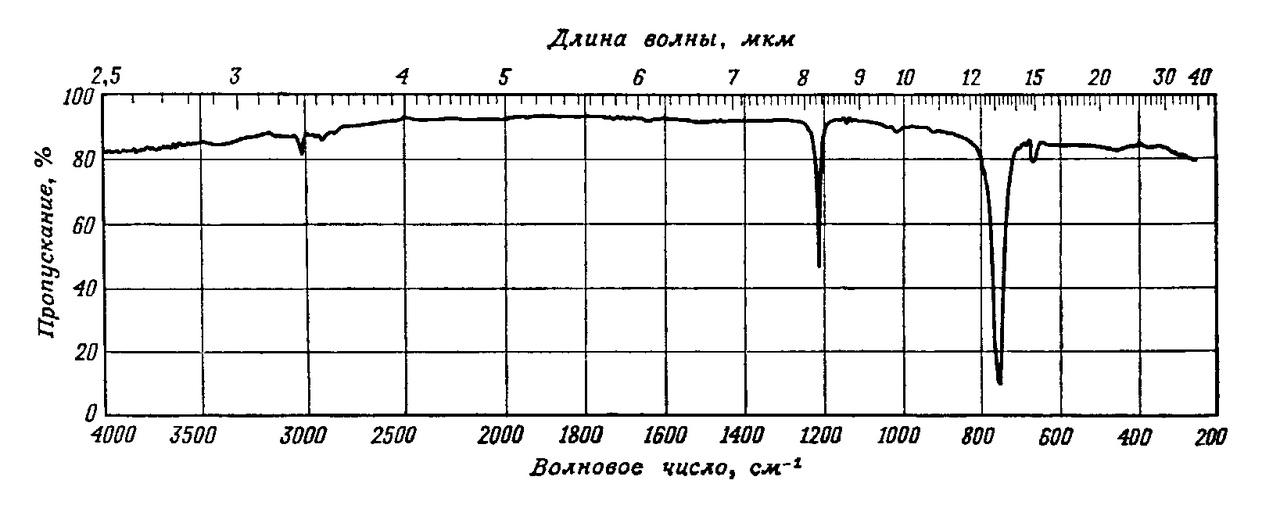
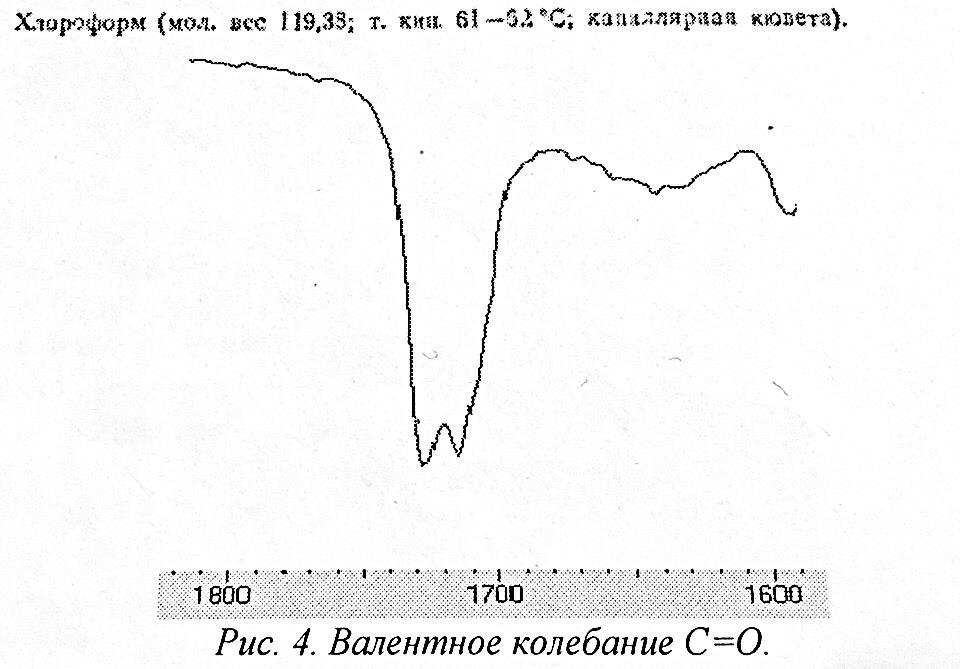
Колебание не обязательно сопровождается появлением инфракрасной полосы поглощения. Поглощение имеет место только тогда, когда колебание приводит к изменению распределения заряда внутри молекулы. Чем больше это изменение, тем сильнее поглощение. Соответственно полосы углеводородов, состоящих только из атомов углерода и водорода, являются слабыми, а полосы, относящиеся к связям, соединяющим атомы, сильно различающиеся между собой по степени электроотрицательности, например С-N, С-О, С=О, С-N, обычно довольно сильными.
Достаточно интенсивные полосы поглощения, проявляющиеся в области, характерной для определенной группы, и пригодные для идентификации этой группы, называются характеристическими полосами поглощения или характеристическими частотами. За последние время собрано огромное количество данных ,относящихся к этим полосам, и многие полосы в области «отпечатков пальцев» теперь также эффективно используются для характеристики различных групп.
При наличии одинарной связи возможны два типа колебаний ,одно из которых связано с изменением длины связи вдоль ее оси(валентные колебания), а другое с изгибом (деформацией) связи. Деформационные колебания химических связей требует меньших частотах ,чем валентные колебания тех связей.