Файл: Бекишев ., Танабаева Б. А. Шыарылан химия есептері (8 11 сыныптар) Алматы аза университеті, 2018.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 683
Скачиваний: 1
СОДЕРЖАНИЕ
§11. Химиялық формулалар бойынша есептеулер
§18. Зат мөлшері. Моль. Авогадро саны. Молярлық масса
§23. Оксидтер. Олардың атаулары
§27. Химиялық реакциялардың жылу эффекті
§28. Авогадро заңы. Газдардың молярлық көлемі. Газдардың салыстырмалы тығыздығы
III тарау. Сутек. Қышқылдар. Тұздар
§31. Сутектің физикалық қасиеттері
§33. Қышқылдар. Құрамы, алу жолдары
§34. Қышқылдардың химиялық қасиеттері
§39. Судың құрамы және физикалық қасиеттері
§42. Негіздер, олардың құрамы және жіктелуі
§45. Оксидтердің химиялық қасиеттері, қолданылуы
§47. Қышқылдардың жіктелуі, алынуы, қасиеттері
§49. Бейорганикалық қосылыстардың арасындағы генетикалық байланыстар
VIII тарау. Сілтілік металдар. Галогендер.
§21. Тыңайтқыштар жайлы қысқаша мәліметтер.
§30. Металдардың электрохимиялық кернеу қатары
§45. Қаныққан көмірсутектер. Метан
§46. Қанықпаған көмірсутектер. Этилен
§53. Оттекті органикалық қосылыстар. Спирттер
§ 1.5. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылымын негіздеу
§ 1.9. Атомдардың валенттілігі және тотығу дәрежесі
II тарау. Химиялық байланыс және зат құрылысы
§ 2.2. Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмі
§ 3.2. Тотығу-тотықсыздану реакциялары
§ 3.3. Ерітінділер мен балқымалардың электролизі
§ 3.4. Судың диссоциациялануы. Сутектік көрсеткіш
§ 3.7. Химиялық реакциялардың жылу эффектісі
§ 3.8. Химиялық реакцияның жылдамдығы
§ 4.6. Қазақстандағы металдар мен бейметалдардың кен орындары
§ 5.3. Натрий және калий қосылыстары
§ 5.5. Судың кермектілігі және оны кетіру жолдары
§ 7.3. Бейметалдардың жалпы сипаттамасы
§ 7.5. Көміртек және оның қосылыстары
§ 7.6. Кремний және оның қосылыстары
§ 7.9. Фосфор және оның қосылыстары
§ 7.12. Күкірт (IV) және күкірт (VI) оксидтері.
§ 8.3. Құймалар. Шойын мен болат өндіру
§ 8.5. Силикат өнеркәсібі. Шыны өндірісі
§ 8.7. Химия және қоршаған ортаны қорғау
6.2. Көмірсутектердің галогентуындыларының қасиеттері
3-сурет.
-
Егер химиялық элемент: а) екінші периодта; ә) үшінші периодта орналасқан болса, қайсысының атомының сыртқы электрондық деңгейінде 5ē болады?
Шешуі:
Көп электронды атомдардың орбитальдарының электрондармен толтырылуы энергияның минимум принципімен, Паули принципімен және Хунд ережесімен анықталады, ал орбитальдардың энергияларының өсуі бойынша орналасуы Клечковский ережесімен анықталады. Осыған сәйкес екінші және үшінші период элементтерінің сыртқы атомдық орбитальдарының электрондармен толтырылуы төмендегі суретте келтірілген. Олар сәйкесінше азот пен фосфор элементтері.

N 2ē)5ē) P 2ē)8ē) 5ē)
-
12Mg, 14Si, 15P, 18Ar атомдарының электрондық және графиктік формулаларын жазыңыздар.
Шешуі:
12Mg электрондық формуласы: 1s22s22p63s2
Графиктік формуласы:
14Si электрондық формуласы: 1s22s22p63s23p2 Графиктік формуласы:
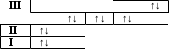
| | | | ↑ | ↑ |
| III | | | ↑↓ | |
| | ↑↓ | ↑↓ | ↑↓ | |
| II | ↑↓ | | | |
| I | ↑↓ | | | |
15P электрондық формуласы: 1s22s22p63s23p3
Графиктік формуласы:
| | | | | ↑ | ↑ | ↑ |
| III | | | | ↑↓ | p | |
| | ↑↓ | ↑↓ | ↑↓ | s | | |
| II | ↑↓ | p | | | | |
| I | ↑↓ | | | | | |
| | s | | | | | |
18Ar электрондық формуласы: 1s22s22p63s23p6 Графиктік формуласы:
| | | | | ↑↓ | ↑↓ | ↑↓ |
| III | | | | ↑↓ | p | |
| | ↑↓ | ↑↓ | ↑↓ | s | | |
| II | ↑↓ | p | | | | |
| I | ↑↓ | | | | | |
| | s | | | | | |
9. Элементтің сыртқы энергетикалық деңгейінің құрылысы мынадай:
| III | ↑↓ | | ↑ |
| | s | | p |
Бұл қай элемент?
Шешуі:
Бұл элемент – III периодта орналасқан, себебі соңғы электрондық қабаты 3-ші деңгеймен аяқталып отыр. Алдыңғы электрондық деңгейшелерінде жалпы 10ē бар деп есептеп оған соңғы 3ē қосамыз, сонда 13ē бар элемент – алюминий.
§ 1.5. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылымын негіздеу
-
Элементтер қандай белгілері бойынша s-, p-, d-, f-топшаларға бөлінеді?
Шешуі:
Валенттік электрондарының орналасуына байланысты элементтер s-, p-, d-, f-топшаларға бөлінеді.
-
Неліктен III периодта d-элементтер жоқ?
Шешуі:
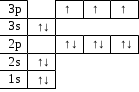
III периодта – үш энергетикалық деңгей болып, соңғы деңгейі ns2np6 электрондық конфигурациясы бар элемент атомдарымен аяқталады. d- электрондық деңгейше 4s2 конфигурациясынан кейін, яғни IV периодтан кейін басталады. Себебі,
d-орбиталінің энергиясы 4s2-ге қарағанда төмен.
| | 3d | | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| IV | 4s | ↑↓ | | | ||||||
| III | 3p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 3s | ↑↓ | | ||||||||
| II | 2p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 2s | ↑↓ | | ||||||||
| I | 1s | ↑↓ | ||||||||
6. Қай деңгейше (5d- немесе 6s-) электрондармен бұрынырақ толтырылады? 5d- және 6s-деңгейшелердің толтырылу реті қандай? Шешуі:
Клечковский ережесі бойынша электрондық деңгейшелердің толуы (n+l) қосындысының өсу реті бойынша, ал (n+l) қосындысы тең болғанда, n санының өсу реті бойынша жүзеге асады. Осыған сәйкес әртүрлі элементтердің атомдарындағы орбитальдардың бірінен кейін бірінің электрондармен толу қатары құрылған:
| Периодтар | I | II | III | IV | V | VI | VII |
| Орбитальдар | 1s | 2s,2p | 3s,3p | 4s,3d,4p | 5s,4d,5p | 6s,4f,5d,6p | 7s,5f,6d,7p |
5d- және 6s-деңгейшелердің толтырылу реті: 6s,4f,5d,6p.
§ 1.9. Атомдардың валенттілігі және тотығу дәрежесі
3. Химиялық элементтердің периодтық жүйесі бойынша валенттік пен тотығу дәрежесінің мәнін қалай анықтауға болады?
Шешуі:
Валенттілік мәні берілген атомның басқа атомдармен қосылғандағы химиялық байланыстың саны ретінде анықталады. Валенттік рим цифрымен көрсетіледі және ол нақты сан, бөлшек сан бола алмайды.
Тотығу дәрежесі – бұл қосылыстар тек иондардан тұрады деп есептегенде табылған қосылыстардағы атомдардың шартты немесе
нақты заряды. Тотығу дәрежесі араб сандарымен өрнектеліп, оң, теріс, нөл және бөлшек сан бола алады.
-
Берілген қосылыстардағы көміртек атомының валенттігі мен тотығу дәрежелерін анықтаңыздар:
Шешуі:
| | а) СО2 | ә) С2Н6 | б) НСООН | в) СН3ОН |
| Валенттігі | IV | IV | IV | IV |
| Тотығу дәрежесін есептейік | х∙1 + (-2)∙2=0 x – 4 = 0 x = - 4 | -х∙2 + 1∙6=0 -2x + 6 = 0 -x = -6/2 х = +3 | 1∙1+x∙1+(-2)∙1+(-2)∙1+1∙1=0 1+x-2-2+1=0 x-2=0 x = +2 | x∙1+3∙1+(- 2)∙1+1∙1=0 x+3-2+1=0 x+2=0 x = -2 |
| Тотығу дәрежесі | - 4 | + 3 | + 2 | - 2 |
-
Келтірілген қосылыстардағы барлық элементтердің тотығу дәрежелерін анықтаңыздар: а) Sn(SO4)2; ә) Na3SbO3; б) BiCl3; в) K2ZnO2; г) РН3. Шешуі:
Қосылыстардың құрамындағы элементтердің тотығу дәрежелерін
«Химия – 10» оқулығының 67-68 беттерінде келтірілген ережелерге сүйеніп есептеуге болады.
| Заттар | Тотығу дәрежесі белгісіз элементтің тотығу дәрежесін есептейік | Тотығу дәрежесі |
| а) Sn(SO4)2 | х∙1+6∙2+(-2)∙8=0 х+12-16=0 x=+4 | +4 |
| б) Na3SbO3 | +1∙3+x∙1+(-2)∙3=0 3+x-6=0 x=+3 | +3 |
| в) BiCl3 | +х∙1+(-1)∙3=0 х-3=0 x=+3 | +3 |
| г) K2ZnO2 | +1∙2+x∙1+(-2)∙2=0 2+x-4=0 x=+2 | +2 |
| е) РН3 | +x∙1+(-1)∙3=0 х-3=0 x=+3 | +3 |

