Файл: Бекишев ., Танабаева Б. А. Шыарылан химия есептері (8 11 сыныптар) Алматы аза университеті, 2018.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 704
Скачиваний: 1
СОДЕРЖАНИЕ
§11. Химиялық формулалар бойынша есептеулер
§18. Зат мөлшері. Моль. Авогадро саны. Молярлық масса
§23. Оксидтер. Олардың атаулары
§27. Химиялық реакциялардың жылу эффекті
§28. Авогадро заңы. Газдардың молярлық көлемі. Газдардың салыстырмалы тығыздығы
III тарау. Сутек. Қышқылдар. Тұздар
§31. Сутектің физикалық қасиеттері
§33. Қышқылдар. Құрамы, алу жолдары
§34. Қышқылдардың химиялық қасиеттері
§39. Судың құрамы және физикалық қасиеттері
§42. Негіздер, олардың құрамы және жіктелуі
§45. Оксидтердің химиялық қасиеттері, қолданылуы
§47. Қышқылдардың жіктелуі, алынуы, қасиеттері
§49. Бейорганикалық қосылыстардың арасындағы генетикалық байланыстар
VIII тарау. Сілтілік металдар. Галогендер.
§21. Тыңайтқыштар жайлы қысқаша мәліметтер.
§30. Металдардың электрохимиялық кернеу қатары
§45. Қаныққан көмірсутектер. Метан
§46. Қанықпаған көмірсутектер. Этилен
§53. Оттекті органикалық қосылыстар. Спирттер
§ 1.5. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылымын негіздеу
§ 1.9. Атомдардың валенттілігі және тотығу дәрежесі
II тарау. Химиялық байланыс және зат құрылысы
§ 2.2. Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмі
§ 3.2. Тотығу-тотықсыздану реакциялары
§ 3.3. Ерітінділер мен балқымалардың электролизі
§ 3.4. Судың диссоциациялануы. Сутектік көрсеткіш
§ 3.7. Химиялық реакциялардың жылу эффектісі
§ 3.8. Химиялық реакцияның жылдамдығы
§ 4.6. Қазақстандағы металдар мен бейметалдардың кен орындары
§ 5.3. Натрий және калий қосылыстары
§ 5.5. Судың кермектілігі және оны кетіру жолдары
§ 7.3. Бейметалдардың жалпы сипаттамасы
§ 7.5. Көміртек және оның қосылыстары
§ 7.6. Кремний және оның қосылыстары
§ 7.9. Фосфор және оның қосылыстары
§ 7.12. Күкірт (IV) және күкірт (VI) оксидтері.
§ 8.3. Құймалар. Шойын мен болат өндіру
§ 8.5. Силикат өнеркәсібі. Шыны өндірісі
§ 8.7. Химия және қоршаған ортаны қорғау
6.2. Көмірсутектердің галогентуындыларының қасиеттері
Шешуі:
| | A | p | n | ē | қысқаша |
| 26Mg | 26 | 12 | 14 | 12 | 26Mg(12p, 14n)12ē 12 |
| 210Pb | 210 | 82 | 128 | 82 | 210Pb(82p, 128n)82ē 82 |
| 129I | 129 | 53 | 76 | 53 | 129I(53p, 76n)53ē 53 |
§ 1.3. Атомдағы электрондардың қозғалысы
-
Әрбір энергетикалық деңгейдегі максимал электрон саны қалай анықталады?
Шешуі:
Әрбір энергетикалық деңгейдегі максимал электрон саны келесі формула арқылы анықталады:
N = 2n2
N – электрон саны, ал n – деңгей нөмірі немесе бас квант саны. Мысалы,
| n | 1 | 2 | 3 | 4 |
| N | 2 | 8 | 18 | 32 |
-
Бас квант санының физикалық мағынасы неде?
Шешуі:
n – деңгей нөмірі немесе бас квант саны. Ол периодтық кестеде период нөміріне сәйкес. Яғни, бас квант саны энергетикалық деңгейдің нөміріне сәйкес және ол электронның энергиясын сипаттайды. Деңгей нөмірі жоғарылаған сайын ондағы электронның энергиясы да жоғарылайды.
-
Келесі элемент атомдарында: а) Si; ә) V; б) Rb; в) Ba қанша энергетикалық деңгейлер және қанша электрондар бар?
Шешуі:
Элементтің нөмірін периодтық кестеден аламыз, ал оның атомындағы энергетикалық деңгейлердің саны элемент орналасқан периодтың нөміріне тең.
| Химиялық элемент | Атомдық нөмірі | Период нөмірі | Электрон саны |
| Si | 14 | III | 14 |
| V | 23 | IV | 23 |
| Rb | 37 | V | 37 |
| Ba | 56 | VI | 56 |
-
2, 8, 5 сандар қатары химиялық элемент атомдарының электрон қабаттарының толуын сипаттайды. Осы элементті атап, оған (периодтық жүйедегі орны бойынша) сипаттама беріңіздер.
Шешуі:
Электрон қабаттарындағы жалпы электрондарының қосындысы – 15 болатынын көріп отырмыз. Атомдық нөмірі 15 болатын элемент – фосфор.
Фосфор – III периодта (сондықтан оның 3 энергетикалық деңгейі бар), V топтың негізгі топшасында орналасқан бейметалл.
-
2, 8, 8, 1 сандар қатары химиялық элемент атомдарының электрон қабаттарының толуын сипаттайды. Бұл қай элемент екенін тауып, оның химиялық қасиеттерін сипаттаңыздар.
Шешуі:
Электрон қабаттарындағы жалпы электрондарының қосындысы – 19 болатынын көріп отырмыз. Атомдық нөмірі 19 болатын элемент – калий.
Калийдің химиялық қасиеттерін сипаттайтын теңдеулер:
| Реакция теңдеуі | Жағдайы | Реакция теңдеуі | Жағдайы |
| 2К + Н2 = 2KH | (200-350оС) | 2K + 2C = K2C2 | |
| [КН + Н2О = КОН + Н2] | | 6K + N2 = 2K3N | |
| 4K + O2 = 2K2O | | | |
| 4K + O2(ауа) + 2Н2О = 4KOН | (бөлме т.) | 2K + 2H2O = 2KOH + H2 | |
| K + O2(ауа) = KO2 | (жану) | K + 6NH3(c) = [K(NH3)6]0 | (-50оС) |
| 2К + Cl2 = 2KCl | (бөлме т.) | 2K + 2HCl(сұйт.) = 2KCl + H2 | |
| 2K + S = K2S | (100-200оС) | 2K + ZnCl2 = Zn + 2KCl | |
Әдебиет: Лидин Р.А. Справочник по общей и неорганической химии. – М.: Просвещение: Учеб. лит., 1997. – 256 с.
-
Атомдық нөмірлері: а) 11 және 19, ә) 16 және 34 элемент атомдарының құрылысында қандай ұқсастықтар мен айырмашылықтар бар?
Шешуі:
| Химиялық элемент | Атомдық нөмірі | Период нөмірі | Топ нөмірі | Электрондық формуласы | Ұқсас- тығы | Айырма- шылығы |
| Натрий | 11 | 3 | I | 1s22s22p63s1 | s1 | 3 период |
| Калий | 19 | 4 | I | 1s22s22p63s23p64s1 | s1 | 4 период |
| Химиялық элемент | Атомдық нөмірі | Период нөмірі | Топ нөмірі | Электрондық формуласы | Ұқсас- тығы | Айырма- шылығы |
| Күкірт | 16 | 3 | VI | [Ne]3s23p4 | 3s23p4 | 3 период |
| Селен | 34 | 4 | VI | [Ar]3d104s24p4 | 4s24p4 | 4 период |
§ 1.4. Энергетикалық деңгейлердің құрылысы
-
а) 3р-деңгейшесі қай элемент атомынан бастап толтырыла бастайды; ә) 3d-орбитальдың толтырылуы қай элементтен басталады; б) 3d- орбитальдың толтырылуы қай элементпен аяқталады?
Шешуі:
Көп электронды атомдардың орбитальдарының электрондармен толтырылуы энергияның минимум принципімен, Паули принципімен және Хунд ережесімен анықталады, ал орбитальдардың энергияларының өсуі бойынша орналасуы Клечковский ережесімен анықталады. Осыған сәйкес 3р-деңгейшесіне алғаш рет он үшінші электрон орналасады. Бұл алюминий элементіне сәйкес (1 – сурет).
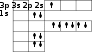
-
сурет -
суретте көріп отырғанымыздай 3d-орбиталіна алғаш рет 21-ші электрон орналасады, ол скандий элементіне сәйкес.
| 3d | | ↑ | | | | | |||
| 4s | ↑↓ | | | ||||||
| 3p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 3s | ↑↓ | | |||||||
| 2p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 2s | ↑↓ | | |||||||
| 1s | ↑↓ | ||||||||
-
сурет. -
суретте көріп отырғанымыздай 3d-орбиталіның толтырылуы 30-шы электронмен аяқталады. Ол мырыш элементіне сәйкес келеді.
| 3d | | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 4s | ↑↓ | | | ||||||
| 3p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 3s | ↑↓ | | |||||||
| 2p | | ↑↓ | ↑↓ | ↑↓ | |||||
| 2s | ↑↓ | | |||||||
| 1s | ↑↓ | ||||||||

