Файл: Бекишев ., Танабаева Б. А. Шыарылан химия есептері (8 11 сыныптар) Алматы аза университеті, 2018.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 657
Скачиваний: 1
СОДЕРЖАНИЕ
§11. Химиялық формулалар бойынша есептеулер
§18. Зат мөлшері. Моль. Авогадро саны. Молярлық масса
§23. Оксидтер. Олардың атаулары
§27. Химиялық реакциялардың жылу эффекті
§28. Авогадро заңы. Газдардың молярлық көлемі. Газдардың салыстырмалы тығыздығы
III тарау. Сутек. Қышқылдар. Тұздар
§31. Сутектің физикалық қасиеттері
§33. Қышқылдар. Құрамы, алу жолдары
§34. Қышқылдардың химиялық қасиеттері
§39. Судың құрамы және физикалық қасиеттері
§42. Негіздер, олардың құрамы және жіктелуі
§45. Оксидтердің химиялық қасиеттері, қолданылуы
§47. Қышқылдардың жіктелуі, алынуы, қасиеттері
§49. Бейорганикалық қосылыстардың арасындағы генетикалық байланыстар
VIII тарау. Сілтілік металдар. Галогендер.
§21. Тыңайтқыштар жайлы қысқаша мәліметтер.
§30. Металдардың электрохимиялық кернеу қатары
§45. Қаныққан көмірсутектер. Метан
§46. Қанықпаған көмірсутектер. Этилен
§53. Оттекті органикалық қосылыстар. Спирттер
§ 1.5. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылымын негіздеу
§ 1.9. Атомдардың валенттілігі және тотығу дәрежесі
II тарау. Химиялық байланыс және зат құрылысы
§ 2.2. Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмі
§ 3.2. Тотығу-тотықсыздану реакциялары
§ 3.3. Ерітінділер мен балқымалардың электролизі
§ 3.4. Судың диссоциациялануы. Сутектік көрсеткіш
§ 3.7. Химиялық реакциялардың жылу эффектісі
§ 3.8. Химиялық реакцияның жылдамдығы
§ 4.6. Қазақстандағы металдар мен бейметалдардың кен орындары
§ 5.3. Натрий және калий қосылыстары
§ 5.5. Судың кермектілігі және оны кетіру жолдары
§ 7.3. Бейметалдардың жалпы сипаттамасы
§ 7.5. Көміртек және оның қосылыстары
§ 7.6. Кремний және оның қосылыстары
§ 7.9. Фосфор және оның қосылыстары
§ 7.12. Күкірт (IV) және күкірт (VI) оксидтері.
§ 8.3. Құймалар. Шойын мен болат өндіру
§ 8.5. Силикат өнеркәсібі. Шыны өндірісі
§ 8.7. Химия және қоршаған ортаны қорғау
6.2. Көмірсутектердің галогентуындыларының қасиеттері
II тарау. Химиялық байланыс және зат құрылысы
§ 2.1. Коваленттік байланыс
-
2p4
↑↓
↑↓
↓
↑↓ ↑
2s2
↑↓
2p4
↑↓
↓
↓
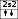 Мынадай молекулалардағы О2, F2, HBr, N2, OF2 атомдардың электрондық конфигурациясын кванттық ұяшықтарда орналастырыңыздар. Олардың арасында қандай ұқсастық бар? Шешуі:
Мынадай молекулалардағы О2, F2, HBr, N2, OF2 атомдардың электрондық конфигурациясын кванттық ұяшықтарда орналастырыңыздар. Олардың арасында қандай ұқсастық бар? Шешуі:

| ↑↓ | | |
| 2p4 | ||

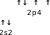 Оттек – О2 Фтор – F2
Оттек – О2 Фтор – F2 

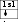

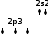 Оттек атомдарының жалқы электрондары жұптасып О2 молекуласын түзеді. Сол сияқты фтор атомдарының жалқы электрондары жұптасып F2 молекуласын түзеді.
Оттек атомдарының жалқы электрондары жұптасып О2 молекуласын түзеді. Сол сияқты фтор атомдарының жалқы электрондары жұптасып F2 молекуласын түзеді.| ↑↓ | ↑↓ | ↑ |
| 4p5 | ||

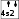
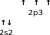 Бромсутек – HBr Азот – N2
Бромсутек – HBr Азот – N2Мұнда сутек атомының бір жалқы электроны мен бром атомының бір жалқы электрон жұптасып, HBr молекуласын түзеді.
Екі азот атомдарының үш жалқы электрондары жұптасып, N2 молекуласын түзеді.
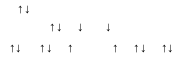

 Бұл кезде оттек атомының екі жалқы электроны мен екі фтор атомдарының жалқы электрондары жұптасып OF2 молекуласын түзеді.
Бұл кезде оттек атомының екі жалқы электроны мен екі фтор атомдарының жалқы электрондары жұптасып OF2 молекуласын түзеді.-
3-жаттығуда берілген молекулалардағы байланыстың еселігін анықтаңыздар.
Шешуі:
| Молекула | О2 | F2 | HBr | N2 | ОF2 |
| Байланыс | О = О | F – F | H – Br | N ≡ N | F – О |
| Байланыс еселігі | 2 | 1 | 1 | 3 | 1 |
8. Келесі молекулалардағы: F2, O2, NH3, SF6 σ- және π- байланыстарының санын және еселігін табыңыздар.
Шешуі:
| Молекула | F2 | O2 | NH3 | SF6 |
| Байланыс | F – F | О = О | N – Н | S – F |
| σ-байланыс | 1 σ | 1 σ | 3 σ | 6 σ |
| π-байланыс | - | 1 π | - | - |
| Байланыс еселігі | 1 | 2 | 1 | 1 |
10. Анықтамалықты пайдаланып берілген молекулаларды байланыс энергиясы мен байланыс ұзындығының артуы бойынша
орналастырыңыздар: а) HCl, HF, HBr, HI; ә) H2Se, H2S, H2Te; б) PH3, AsH3, NH3; в) BCl3, BeCl2, CCl4.
Шешуі:
Үлгі:
| Сипаттамалар | HF | HCl | HBr | HI |
| Байланыс ұзындығы, нм | 0,092 | 0,127 | 0,141 | 0,161 |
| Байланыс ұзындығы артады |  | |||
| Байланыс энергиясы, Но кДж/моль | -270,7 | -92,3 | -36,3 | +26,6 |
| Байланыс энергиясы артады |  | |||
§ 2.2. Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмі
6. Мына қосылыстағы кешентүзушінің координациялық саны нешеге тең: K3[Fe(CN)6]?
Шешуі:
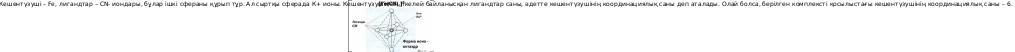
§ 2.4. Иондық байланыс. Иондық және коваленттік қосылыстардың қасиеттері
-
Екі молекуланың KCl, LiF қайсысының иондық дәрежесі басым? Жауап бергенде атомдардың электртерістігін қолданыңыздар.
Шешуі:
Байланыстың иондық дәрежесі оны түзетін элементтердің электртерістіктері () мәндерінің айырымына байланысты. Есептің шартында келтірілген қосылыстардағы байланыс түзетін элементтердің электртерістіктерінің мәндері мынадай:
| Э | K | Cl | Li | F | (KCl) = 3,0 – 0,8 = 2,2 (LiF) = 4,0 – 1,0 = 3,0 |
| | 0,8 | 3,0 | 1,0 | 4,0 |
Демек, литий фториді қосылысындағы байланыстың иондық дәрежесі калий хлоридіне қарағанда басымырақ.
-
Натрий хлориді 8000С кезінде балқиды, ал бром (V) йодиді BrI5 бөлме температурасында сұйықтыққа айналады. Бұл айырмашылықтың себебін түсіндіріңіздер.
Шешуі:
Себебі натрий мен хлор арасындағы байланыстың иондық дәрежесі жоғары, ал бром мен йод арасындағы байланыстың типі – ковалентті полюсті. Иондық байланыстың күші ковалентті байланысқа қарағанда едәуір жоғары. Иондық байланысты үзуге көп энергия жұмсалады.
-
Br2, HBr, KBr қосылыстарындағы химиялық байланыстың типін анықтаңыздар. Олардың түзілу сызбанұсқасын жазыңыздар.
Шешуі:
Анықтамалық кестелерден элементтердің электртерістіктерінің мәндерін тауып, айырмаларын есептейміз: (Br) = 2,6; (H) = 2,1; (K) = 0,89.
Л. Полинг бойынша, егер элементтердің электртерістіктерінің айырмасы 1,7 болса, онда байланысты иондық, ал 1,7 болса, онда байланысты ковалентті полюсті деп айтуға болады.
| Заттар | Br2 | HBr | KBr |
| | 2,6 - 2,6 = 0 | 2,6 – 2,1 = 0,5 | 2,6 – 0,89 = 1,71 |
| Байланыстың типі | Ковалентті полюссіз | Ковалентті полюсті | Иондық |
Әдебиет: Л.Полинг. Общая химия. – М.: Мир., 1974. – С.168-170.
-
CaCl2, ақ фосфор, кремнезем байланыс типі және кристалдық торлары бойынша қалай ерекшеленеді?
Шешуі:
| Заттар | CaCl2 | Ақ фосфор | Кремнезем |
| Байланыс типі | Иондық | Ковалентті полюссіз | Ковалентті полюсті |
| Кристалдық торының типі | Иондық | Атомдық | Атомдық |
9. Қосылыстардың графиктік құрылымынан атомдар арасындағы байланыстың типін анықтаңыздар:

 Шешуі:
Шешуі:
| K – C ≡ N | Na – O | N ≡ N |
| | C= O | |
| Көміртек пен азот арасындағы байланыстың типі – ковалентті полюсті, ал калий мен циан иондарының арасындағы байланыс иондық байланысқа жатады. | Na – O | Екі азот атомдары арасындағы байланыстың типі – ковалентті полюссіз |
| Көміртек пен оттек арасындағы байланыстың типі – ковалентті полюсті, ал натрий мен карбонат иондарының арасындағы байланыс иондық байланысқа жатады. |
III тарау. Химиялық реакциялар және олардың жүруінің негізгі заңдылықтары
§ 3.1.Химиялық реакциялардың жіктелуі
5. Берілген реакциялар не себепті аяғына дейін жүреді? Коэффициенттерін қойыңыздар:
а) AlCl3 + AgNO3 = AgCl + Al(NO3)3 б) KOH + H3PO4 = K3PO4 + H2O
в) K2CO3 + HBr = KBr + CO2 + H2O
Шешуі:
Электролит ерітінділеріндегі иондар арасындағы реакциялар нәтижесінде тұнба түзілетін, газ тәрізді зат бөлінетін және нашар диссоциацияланатын заттар түзілетін жағдайларда аяғына дейін жүреді.
а) AlCl3 + 3AgNO3 = 3AgCl↓ + Al(NO3)3 б) 3KOH + H3PO4 = K3PO4 + 3H2O
в) K2CO3 + 2HBr = 2KBr + CO2↑ + H2O
§ 3.2. Тотығу-тотықсыздану реакциялары
-
Берілген реакция теңдеулеріндегі тотықтырғыш пен тотықсыздандырғышты анықтап, олардың тотығу дәрежесі қалай өзгеретінін табыңыздар.
а) Zn + Cl2 = ZnCl2 ә) P2O5 + 5C = 2P + 5CO б) 2KClO3 = 2KCl + 3O2
Шешуі:
а) Zn0 + Cl 0 = Zn+2Cl -
2 2
2
тотықсыздандырғыш Zn0 – 2ē → Zn+2 /1 тотығу тотықтырғыш Cl 0 + 2ē → 2Cl-2 /1 тотықсыздану
Zn + Cl2 = ZnCl2
ә) P +5O -2 + C0 = P0 + C+2O-2
2 5
тотықтырғыш Р+5 + 5ē → Р0 /2 тотықсыздану тотықсыздандырғыш C0 – 2ē → 2C+2 /5 тотығу
P2O5 + 5C = 2P + 5CO
б) K+1Cl+5O -2 = K+Cl- + O 0
3 2
2
тотықтырғыш Cl+5 + 5ē → Cl- /4 тотықсыздану тотықсыздандырғыш 2O-2 – 4ē → O 0 /5 тотығу
2KClO3 = 2KCl + 3O2
-
Берілген реакцияларды электрондық баланс әдісімен теңестіріңіздер:
Шешуі:
а) C + HNO3 = CO2 + NO + H2O б) H2S + FeCl3 = S↓ + FeCl2 + HCl
в) KI + KIO3 + H2SO4 = I2 + K2SO4 + H2O
а) C0 + HN+5O3 = C+4O2 + N+2O + H2O
тотықсыздандырғыш C0 – 4ē → C+4 /3 тотығу тотықтырғыш N+5 + 3ē → N+2 /4

