ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 140
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
Рассчитывают относительную погрешность определения NO2- по массе
D=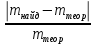 ∙100%
∙100%
-
Вопросы для самоконтроля
Какова природа возникновения спектров поглощения?
Спектры каких переходов используются в фотометрии?
Основной закон светопоглощения и его параметры?
Какие факторы влияют на оптическую плотность раствора и молярный коэффициент светопоглощения?
Физический смысл молярного коэффициента светопоглощения?
Причины отклонения от закона Бугера-Ламберта-Бера?
Классификация фотометрических методов анализа?
Принципиальная схема приборов для абсорбционной фотометрии и их работа?
Назначение основных узлов фотометрических приборов?
Спектральные характеристики растворов?
Принципы выбора аналитических длин волн?
Оптимальные условия фотометрических измерений?
Фотометрические реагенты и требования, предъявляемые к ним?
Приёмы, применяемые для фотометрических измерений?
Качественный и количественный анализ в фотометрии?
Определение смеси светопоглощающих веществ?
Принципы фотометрического титрования?
Область фактического применения фотометрических методов анализа?
Метрологические характеристики фотометрических методов анализа?
Какие из соединений
можно определять в УФ-области спектра
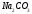 ,
,
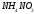 ,
,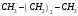 ,
,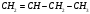 ?
?
Какие из соединений
можно определять в видимой области
 ,
,
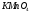 ,
,
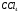 ?
?
Предложите оптимальные условия (интервал b и c) для фотометрического определения титана с Н2О2 (молярный коэффициент поглощения равен 720).
Вычислите молярный коэффициент поглощения соединения железа, если А = 0,75, b = 5 см, в 50 см3 раствора содержится 0,005 г железа.
Рассчитайте оптическую плотность раствора, светопропускание которого равно 60%.
-
Фототурбидиметрия.
-
Цель и задачи работы
-
Изучение работы фотометрических приборов, овладение навыками практического применения фототурбидиметрического и кинетического фототурбидиметрического методов.
-
Оборудование и реактивы
1. Фотоэлектроколориметр КФК-2;
2. Рабочий раствор сульфата натрия,
 =
=
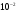 мг/см3.
Навеску 0,8872 г прокаленного х.ч.
мг/см3.
Навеску 0,8872 г прокаленного х.ч.
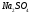 растворяют в 1000 см3. Полученный
раствор,
растворяют в 1000 см3. Полученный
раствор,
 = 0,2 мг/см3, разбавляют в 20 раз;
= 0,2 мг/см3, разбавляют в 20 раз;
3. Хлорид бария, водный раствор, 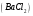 = 10%;
= 10%;
4. Электролит
 ,
водный раствор. К навеске 240 г х.ч.
,
водный раствор. К навеске 240 г х.ч.
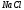 приливают 20,5 см3 х.ч.
приливают 20,5 см3 х.ч.
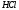 ( = 1,17 г/см3)
и доводят объем раствора до 1 дм3
дистилированной водой;
( = 1,17 г/см3)
и доводят объем раствора до 1 дм3
дистилированной водой;
5. Мерные колбы объемом 100 см3, 7 шт.;
6. Градуированная пипетка объемом 20 см3 , 2шт.;
7. Мерная пипетка объемом 15 см3 , 1шт;
8. Бюретка объемом 25 см3 , 1шт.
-
Определение сульфатов в растворе
Метод основан на измерении
интенсивности светового потока,
проходящего через дисперсную систему.
Образование дисперсной системы
малорастворимого в кислых растворах
сульфата бария (ПР =
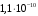 )
происходит по реакции:
)
происходит по реакции:
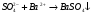
Избирательность определения сульфатов относительно карбонатов, фосфатов, хроматов обеспечивается проведением реакции в кислой среде.
Ход работы.
-
Приготовление стандартных растворов и раствора сравнения:
Готовят 5 стандартных растворов,
содержащих 20; 40; 80; 120 и 200 мкг
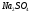 в 100 см3 раствора. Для этого в
мерные колбы объемом 100 см3
вносят 2; 4; 8; 12 и 20 см3 рабочего
раствора
в 100 см3 раствора. Для этого в
мерные колбы объемом 100 см3
вносят 2; 4; 8; 12 и 20 см3 рабочего
раствора
 .
.
В каждую колбу приливают по 20 см3 раствора электролита и соответственно 38; 36; 32; 28 и 20 см3 дистиллированной воды, перемешивают.
Затем приливают 15 см3 хлорида бария, перемешивают, доводят объем до метки дистиллированной водой и снова перемешивают.
Раствор сравнения готовят аналогично стандартным в колбе объемом 100 см3 без сульфата натрия.
-
Построение градуировочного графика:
Через 5 мин. измеряют оптическую плотность стандартных растворов по отношению к раствору сравнения в порядке понижения концентрации в кюветах (толщина поглощающего слоя 50 мм) с синим светофильтром.
Результаты измерений заносят в таблицу 10.1.
Строят градуировочный график A=f(m(SO42-)).
-
Контрольная задача. Определение содержания
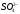 в растворе.
в растворе.
Пробу анализируемого раствора доводят до метки дистиллированной водой в мерной колбе объемом 100 см3. Отбирают три аликвотные части по 10 см3 в мерные колбы и готовят суспензии.
Измеряют их оптические плотности и находят среднее значение.
Пользуясь градуировочным
графиком, находят концентрацию
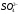 в исследуемом растворе.
в исследуемом растворе.
-
Клетки
-
Оформление лабораторного журнала.
-
Определение сульфатов турбидиметрическим методом.
-
1. Цель и задачи работы.
2. Уравнение фотометрической реакции.
3. Ход определения.
3.1. Ход приготовления серии стандартных растворов.
3.2. Ход приготовления раствора сравнения.
Ход определения.
3.3. Определение сульфатов методом градуировочного графика.
Данные для построения градуировочных зависимостей.
Таблица 9.2.1.2.
|
№ стандартного раствора |
m (SO42-), мкг |
Концентрация SO42-, моль/дм3 |
Оптическая плотность (А) относительно раствора сравнения (градуировочный график) |
|
КФК-2 (l=5,0 см) |
|||
|
1 |
20 |
|
|
|
|
|||
|
|
|||
|
2 |
40 |
|
|
|
|
|||
|
|
|||
|
3 |
80 |
|
|
|
|
|||
|
|
|||
|
4 |
120 |
|
|
|
|
|||
|
|
|||
|
5 |
200 |
|
|
|
|
|||
|
|
|||
|
Контрольный раствор |
|
|
|
|
|
|||
|
|


