ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 145
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Приготовление стандартных растворов:
Готовят шесть стандартных растворов, содержащих 5,0; 10,0; 15,0; 20,0; 25,0; 30,0 мг меди в 50 см3 раствора. Для этого в мерные колбы вместимостью 50 см3 вносят рабочий раствор, объемом 1,0; 2,0; 3,0; 4,0; 5,0; 6,0 см3 соответственно, добавляют в каждую колбу 10 см3 раствора аммиака и доводят объёмы до метки дистиллированной водой. К измерениям приступают через десять минут.
-
Приготовление раствора сравнения.
В мерную колбу, вместимостью 50 см3 вносят 10 см3 раствора аммиака и доводят объёмы до метки дистиллированной водой.
-
Выбор светофильтра
Раствор, имеющий наиболее интенсивную окраску, фотометрируют относительно раствора сравнения (или воды), со всеми светофильтрами поочерёдно, записывая результаты измерений в таблицу 9.2.1.1.
Строят спектральную характеристику
раствора в координатах
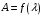 и выбирают в качестве рабочего светофильтр,
соответствующий наибольшему значению
светопоглощения.
и выбирают в качестве рабочего светофильтр,
соответствующий наибольшему значению
светопоглощения.
-
Определение меди(II) по методу градуировочного графика.
1. Построение градуировочного графика.
С выбранным светофильтром поочередно фотометрируют все растворы стандартной серии относительно раствора сравнения.
Результаты измерений заносят в таблицу
9.2. и строят градуировочный график в
координатах
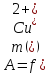
2. Контрольная задача.
К анализируемому раствору, содержащему соль меди (II), приливают 10 см3 аммиака и доводят объем раствора до 50 см3 дистиллированной водой. Подготовленную пробу фотометрируют относительно раствора сравнения при выбранном светофильтре. Измерения повторяют 3-5 раз. Результаты заносят в таблицу 9.2.1.1.
-
Определение меди(II) дифференциальным методом.
1. Построение графика дифференциальным методом.
С выбранным светофильтром поочерёдно фотометрируют стандартные растворы относительно раствора сравнения, содержащего 10,0 мг меди в 50 см3 раствора (раствор №2 стандартной серии).
Если содержание меди в фотометрируемом растворе меньше, чем в растворе сравнения, применяют обратный порядок измерений: фотометрируемый раствор принимают за «нулевой» раствор сравнения, т.е. устанавливают по нему оптический нуль прибора, а найденное значение оптической плотности берут со знаком «минус».
Результаты измерений вносят в таблицу
9.2.1.2. и строят градуировочный график в
координатах
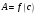 .
.
2. Контрольная задача. Определение содержания меди (II) в анализируемом растворе.
К анализируемому раствору, содержащему соль меди (II), приливают 10 см3 раствора аммиака и доводят объём до 50 см3 дистиллированной водой. При определении меди в твёрдых пробах их предварительно растворяют по соответствующим методикам.
Подготовленную пробу фотометрируют относительно раствора сравнения,содержащего 5 мг меди, применяя при необходимости приём двухстороннего дифференцирования.
Измерения повторяют 3-5 раз. Результаты заносят в таблицу 9.2.1.4.
-
Определение железа (III) методом градуировочного графика
Метод основан на образовании окрашенного
красного комплекса ионов железа с
сульфосалициловой кислотой состава
1:2, имеющего максимальный выход при
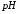 = 4.
= 4.
Ход работы:
-
Приготовление стандартных растворов:
Готовят шесть стандартных растворов, содержащих 0,1; 0,2; 0,3; 0,4; 0,5; и 0,6 мг железа (III) в 50 см3, используя в качестве реагентов 30 см3 раствора сульфосалициловой кислоты и 5 см3 буферного раствора.
-
Приготовление раствора сравнения
В мерную колбу, вместимостью 50 см3, вносят 30 см3 раствора сульфосалициловой кислоты и 5 см3 буферного раствора и доводят до метки дистиллированной водой.
-
Выбор светофильтра
Раствор, имеющий наиболее интенсивную окраску, фотометрируют относительно раствора сравнения со всеми светофильтрами поочерёдно, записывая результаты измерений в таблицу 9.2.1.1.
Строят спектральную характеристику
раствора в координатах
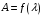 и выбирают в качестве рабочего светофильтр,
соответствующий наибольшему значению
светопоглощения.
и выбирают в качестве рабочего светофильтр,
соответствующий наибольшему значению
светопоглощения.
-
Определение железа (III) по методу градуировочного графика
1. Построение градуировочного графика.
С выбранным светофильтром поочередно фотометрируют все растворы стандартной серии относительно раствора сравнения. Результаты измерений заносят в таблицу 9.3 и строят градуировочный график в координатах A = f (m(Fe3+))
2. Контрольная задача. Определение содержания железа (III) в анализируемом растворе:
К анализируемому раствору приливают 30 см3 раствора сульфосалициловой кислоты и 5 см3 буферного раствора, доводят объём до 50 см3 дистиллированной водой.
Фотометрирование проводят через 10 минут относительно раствора сравнения. Измерения проводят пять раз и по среднему результату графически находят содержание железа (III) в пробе.
-
Определение титана (IV) методом градуировочного графика
Титан (IV) образует в пероксидом водорода в кислой среде желтый комплекс состава [Ti(OH)2H2O2]2+. Устойчивость комплекса невелика (β1≈104), поэтому для полноты его образования требуется значительный избыток пероксида водорода. Наиболее подходящей средой для реакции титана с пероксидом водорода являются сернокислые растворы (0,5-1 М H2SO4).
Пероксидная методика обладает малой
чувствительностью (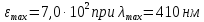 ),
но широко используется в практике
молекулярного абсорбционного анализа.
Ее с успехом применяют для определения
титана в сталях, чугунах, тантале,
жаропрочных сплавах, ильменитовых
концентратах, железных рудах и т.д.
),
но широко используется в практике
молекулярного абсорбционного анализа.
Ее с успехом применяют для определения
титана в сталях, чугунах, тантале,
жаропрочных сплавах, ильменитовых
концентратах, железных рудах и т.д.
Мешают определению титана фосфаты, фториды, оксалаты и цитраты, связывающие его в комплексы, а также ионы металлов, обладающие собственной окраской или образующие пероксидные комплексы (V, Mo, U, Nb, Cr).
Ход работы.
-
Приготовление стандартных растворов:
В пять мерных колб, вместимостью 50,0 мл, вводят стандартный раствор титана с содержанием (мг): 0,5; 1,0; 1,5; 2,0; 2,5 соответственно, 20 мл воды, 5 мл серной кислоты, 3 мл раствора пероксида водорода. Содержимое колб разбавляют водой до метки.
-
Приготовление раствора сравнения
В мерную колбу, вместимостью 50 см3, вносят 5 мл серной кислоты, 3 мл раствора пероксида водорода. Содержимое колб разбавляют водой до метки.
-
Определение титана (IV) по методу градуировочного графика
1. Построение градуировочного графика:
С выбранным светофильтром (λ=410 нм) поочередно фотометрируют все растворы стандартной серии относительно раствора сравнения. Результаты измерений заносят в таблицу 9.3 и строят градуировочный график в координатах A = f (m(Ti4+))
2. Контрольная задача. Определение содержания титана (IV) в анализируемом растворе:
К анализируемому раствору приливают 20 мл воды, 5 мл серной кислоты, 3 мл раствора пероксида водорода. Содержимое колб разбавляют водой до метки.
Фотометрирование проводят через 10 минут относительно раствора сравнения. Измерения проводят пять раз и по среднему результату графически находят содержание титана (IV) в пробе.
-
Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
Метод основан на взаимодействии фосфора с молибдатом аммония и образовании при этом желтого комплекса гетерополикислоты (ГПК) H3[P(Mo3O10)4]∙nH2O, который в дальнейшем восстанавливается и окрашивает раствор в синий цвет (ε830=26800 моль/дм3∙см)
Ход определения.
-
Приготовление стандартных растворов:
В 6 мерных колб, вместимостью 50 см3 вносят рассчитанные объемы дигидрофосфата калия: 0,2; 0,5; 1,0; 1,5; 2,0; 2,5 (см3), содержащие: 0,02; 0,05; 0,1; 0,15; 0,2; 0,25 (мг фосфора). Затем приливают по 20,0 см3 дистиллированной воды, 5,0 см3 раствора парамолибдата аммония, 2,0 см3 аскорбиновой кислоты и доводят до метки дистиллированной водой.
Растворы стандартной серии фотометрируют относительно раствора сравнения через 15 минут после их приготовления при выбранной рабочей длине волны 850 нм с помощью прибора «Эксперт-003». Каждый раствор фотометрируют 3-5 раз.
-
Приготовление раствора сравнения
Для приготовления раствора сравнения в мерную колбу, вместимостью 50 см3, вносят 20,0 см3 дистиллированной воды, 5,0 см3 раствора парамолибдата аммония, 2,0 см3 аскорбиновой кислоты и доводят до метки дистиллированной водой.


