Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 509
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
В случае полимолекулярной адсорбции изотерма адсорбции имеет более сложный характер. Для описания процесса применяют другие теории, например, БЭТ (Бруннауэра, Эммета и Тейлора), которую широко применяют при измерении удельной поверхности порошков и пористых материалов.
Для проверки применимости того или иного уравнения изотермы адсорбции используют линейную форму уравнения. Если экспериментально полученные данные располагаются на этой прямой, то уравнение применимо. В этом случае возможно определить входящие в уравнение изотермы постоянные.
Линейная форма уравнения Фрейндлиха определяется в логарифмических координатах lgГ = f(lgC):
Если при этом экспериментальные точки укладываются на прямую, то результаты опытов согласуются с уравнением Фрейндлиха. Отрезок ординаты, отсекаемый прямой равен lga, а тангенс угла наклона – 1/n.
Приведение уравнения Ленгмюра к линейному виду возможно двумя способами:
1)
При такой записи уравнения Ленгмюра график зависимости строят в координатах 1/Г – 1/С. Свободный член полученного уравнения прямой равен 1/Г∞, а угловой коэффициент –
2)
В этом случае график зависимости строят в координатах С/Г – С. Свободный член полученного уравнения прямой равен
Ионообменная адсорбция
Сущность ионообменного механизма заключается в стехиометрическом замещении ионов в твердой фазе на ионы из раствора. При донорно-акцепторном взаимодействии сорбент выступает в роли полимерного лиганда.
Ионообменная адсорбция имеет ряд особенностей.
1. Сорбируются заряженные частицы (ионы).
2. Адсорбция идет только на полярных сорбентах. Отсюда ее другое название – полярная адсорбция.
3. Адсорбция сопровождается образованием двойного электрического слоя, состоящего из адсорбированных поверхностью ионов какого-либо вида и знака (потенциалопределяющих ионов) и связанных с ними электростатическими силами ионов противоположного знака (противоионов). Последние, находясь в динамическом равновесии с ионами раствора, являются подвижными и обмениваются на ионы того же знака, присутствующими в растворе.
4. В отличие от адсорбции молекул адсорбция ионов из растворов происходит избирательно: на данном сорбенте адсорбция ионов происходит не одинаково эффективно.
5. В основе ионной сорбции лежит химическое взаимодействие сорбента с сорбируемым веществом. Обмен противоионов происходит в строго эквивалентном отношении и может быть описан стехиометрическим уравнением.
6. Чем более полярным является сорбент, тем лучше он сорбирует оны из водных растворов.
7. Чем больше кристаллографический радиус иона при одинаковом заряде, тем лучше он сорбируется. По способности к адсорбции ионы располагаются в ряд (ряды Гедройца, Гофмейстера). Например, в ряду Li+ – Na+ – K+ – Rb+ – Cs+ – Mg2+ – Ca2+ – Sr2+ – Ba2+ –Al3+ – Fe2+ или Cl− – Br− – NO3− – I− – CNS− адсорбционная способность увеличивается.
Ионный обмен широко распространен в природе и имеет большое практическое значение. Он характерен для многих твердых природных адсорбентов, таких как почвы, глины, силикагели, алюмогели, цеолиты (молекулярные сита), а также для специально синтезируемых полимерных материалов типа смол, называемых ионитами.
Ионообменные смолы представляют собой зернистый материал с гранулами сферической или неправильной формы. Такие иониты состоят из пространственно «сшитых» углеводородных цепей (матриц) с жесткозакрепленными на них ионогенными группами – фиксированными ионами. Матрица полимера с фиксированными анионами представляет собой полианион, а катионами – поликатион. Заряд полииона нейтрализуется распределенными внутри полимера ионами противоположного знака (противоионами), которые могут вступать в реакцию обмена с ионами того же знака заряда, находящимися в растворе. Таким образом, если фиксированные ионы несут отрицательный заряд (SO
3, COO, PO32, AsO32), то ионит способен к обмену катионов и является катионитом:
Если фиксированные ионы несут положительный заряд (NH3+, =NH2+, [=N=]+, [S=]+), то ионит способен к обмену анионов и является анионитом:
Чертой сверху принято обозначать твердую фазу сорбента.
Главными характеристиками ионообменного процесса (и процесса сорбции вообще) являются коэффициент распределения, коэффициент селективности и константа ионного обмена.
Коэффициент распределения определяется формулой:
где
Коэффициент селективности определяется соотношением коэффициентов раствоределения целевого (i) и примесного (j) компонентов:
Константа ионного обмена характеризует избирательную способность ионита. В общем виде процесс ионного обмена можно записать как реакцию:
где R – матрица катионита или анионита; X и Y – обменные ионы; z – заряд иона раствора, заряд обменного иона ионита является единичным.
Константа равновесия ионного обмена:
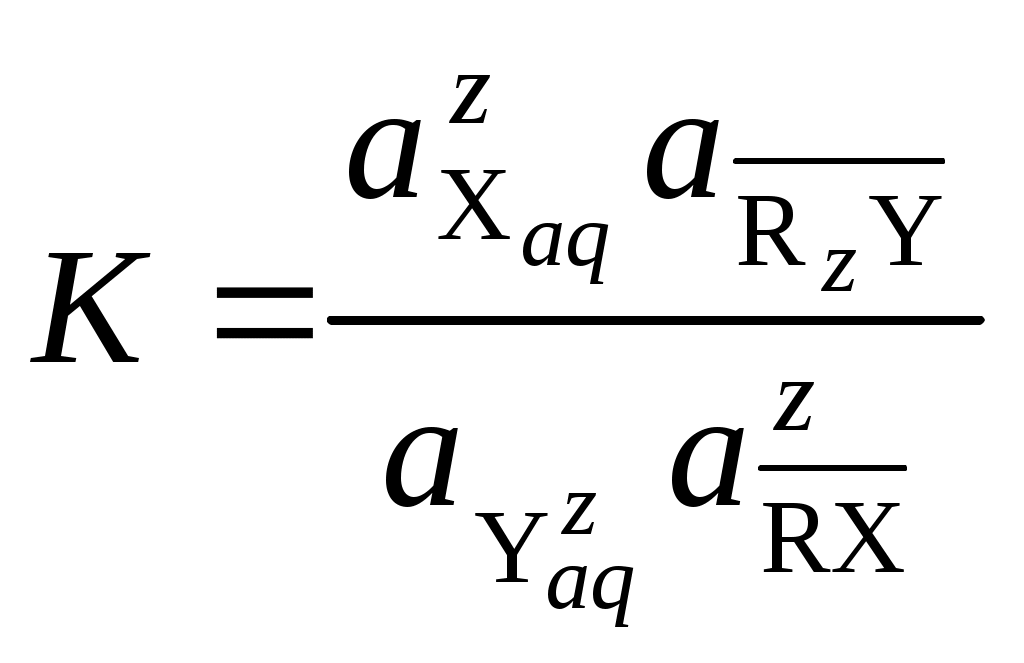 .
. Для не очень строгих расчетов активности компонентов в фазе сорбента
Для однозарядных обменных ионов можно записать следующее выражение константы равновесия с учетом того, что концентрация вещества в фазе сорбента определяется его адсорбцией:
 ,
,которое называется уравнением Никольского.
Основным критерием при оценке пригодности ионита для той или иной операции является его обменная емкость число моль или эквивалентов вещества, поглощаемое единицей массы или объема смолы. Различают полную обменную емкость (ПОЕ), емкость до проскока или динамическую обменную емкость (ДОЕ) и статическую обменную емкость.
ПОЕ характеризует общую поглотительную способность ионита, полученную в динамических условиях, до наступления насыщения. ПОЕ – величина, соответствующая концентрации в фазе сорбента функциональных групп, способных к ионному обмену Полную обменную емкость можно рассчитать, исходя из эквивалентной массы элементарного звена полимера, содержащего одну ионогенную группу. Однако для большинства ионитов, выпускаемых промышленностью, ПОЕ лишь приближается к расчетной величине. Это объясняется трудностью введения ионогенных групп при синтезе смол.
ДОЕ определяется как величина емкости, которую можно усреднено приписать сорбенту по результатам определения объема профильтрованного через него раствора одного сорбируемого вещества определенной концентрации до его появления в фильтрате (до проскока). Обычно концентрацию проскока принимают равной ПДК. ДОЕ определяет технологические возможности сорбента.
Определение емкости динамическим методом осуществляется в колонке, заполненной слоем ионита, через который медленно фильтруется раствор электролита известной концентрации. Габариты колонки, толщина слоя катионита, концентрация и состав рабочего раствора, скорость фильтрации и порядок отбора проб задаются исходя из конкретных исследовательских задач. При контрольном тестировании ионитов следует руководствоваться рекомендациями ГОСТов.
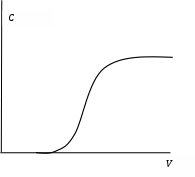
Рис. 14. Выходная кривая сорбции в динамических условиях
Полученная в результате эксперимента зависимость концентрации вещества в фильтрате от его объема называется выходной кривой (рис. 14).
Емкость смолы в конкретных условиях сорбции, измеренная в статическом режиме в перемешиваемой системе, называется статической обменной емкостью (СОЕ). Значение СОЕ [% (по массе), или % (объемн.)] меньше полной обменной емкости.
Многочисленные исследования показали, что процесс обмена противоионов включает в себя 5 последовательных стадий:
1) перемещение вытесняемого иона через пленку раствора, окружающую зерно, к его поверхности (пленочная, внешнедиффузионная кинетика);
2) перемещение вытесняющего иона внутри зерна к фиксированным ионам, т. е. к точке обмена (гелевая, внешнедиффузионная кинетика);
3) химическая реакция двойного обмена (химическая кинетика);
4) перемещение вытесняемого иона внутри зерна от точки обмена к поверхности;
5) перемещение вытесняемого иона через пленку раствора, окружающую зерно, вглубь раствора.
Суммарная скорость многостадийного процесса определяется скоростью наиболее медленной стадии. Выявление этой стадии и является первым этапом изучения кинетики ионного обмена.
Обычно рассматриваются не пять, а три стадии, поскольку первая и пятая, вторая и четвертая стадии являются однотипными и передают лишь разное по направлению перемещение обменивающихся ионов. Из трех стадий стадия двойного обмена определяется химической кинетикой – реакцией первого, второго и др. порядков; остальные две стадии носят диффузионный характер.
Если скорость процесса не зависит от размера зерна ионита, то лимитирующей стадией является химическая кинетика. Зависимость скорости обмена от размера зерен ионита указывает решающую роль одного из диффузионных процессов. Поставив эксперимент по изучению зависимости скорости обмена от скорости перемешивания (статические условия) либо от скорости пропускания раствора (динамические условия)на ионитах с одинаковым временем контакта, можно установить, какой из диффузионных процессов (гелевый или пленочный) имеет решающее значение. Изменение скорости обмена от скорости перемешивания или пропускания раствора указывает на определяющую роль пленочной кинетики.
Надежные сведения о том или ином механизме диффузии дает метод прерывания. Зерна ионита в определенный момент удаляют из раствора, а затем снова помещают в тот же самый раствор. В случае, если процесс определяется гелевой кинетикой, после перерыва скорость процесса становится более высокой, чем до прерывания процесса. Если процесс определяется пленочной кинетикой никакого изменения в характере выходной кривой не наблюдается.
