Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 519
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
Линейная скорость взаимного перемещения фаз под действием электрического поля определяется уравнением Гельмгольца-Смолуховского:
где ε – диэлектрическая проницаемость среды; ζ - электрокинетический потенциал; η – вязкость дисперсионной среды; Н - напряженность электрического поля,
где Е – разность потенциалов, В; L – расстояние между электродами, м.
Коагуляция лиофобных коллоидно-дисперсных систем чаще всего вызывается электролитами. Коагуляцию вызывают ионы, противоположные по знаку заряду коллоидных частиц.
Минимальная концентрация электролита, начиная с которой за определенный промежуток времени в коллоидном растворе наблюдается видимый эффект коагуляции (изменение цвета, помутнение, появление хлопьевидного осадка) называется порогом коагуляции или критической концентрацией Скр. Эта величина служит сравнительной мерой агрегативной устойчивости дисперсной системы и коагулирующей способностью ионов электролита.
Величина порога коагуляции вычисляется по формуле:
где СЭЛ – концентрация раствора электролита, применяемого для коагуляции, VЭЛ – наименьший объем раствора электролита, V – суммарный объем коллоидного раствора с электролитом.
В соответствии с правилом Шульце-Гарди пороги коагуляции уменьшаются с увеличением заряда иона-коагулянта и, согласно теории Дерягина-Ландау обратно пропорционально шестой степени этого заряда. Например, пороги коагуляции для одно- двух- и трехвалентных ионов
а их коагулирующая способность Р (величина, обратная порогу коагуляции) соответственно относится как
PI:PII:PIII = 1:64:729.
Для прогноза устойчивости дисперсных систем и выбора коагулянта необходимо представлять строение коллоидной частицы – мицеллы.
В состав мицеллы входит ядро, состоящее из агрегата атомов, молекул или ионов (от ста до миллионов), на поверхности которого образуется двойной электрический слой. Ядро + слой потенциалопределяющих ионов + плотный слой противоионов составляет гранулу мицеллы. Гранула имеет заряд который совпадает по знаку с зарядом потенциалобразующих ионов. Противоионы
диффузного слоя уравновешивают заряд гранулы, таким образом, мицелла в целом нейтральна.

Строение коллоидных частиц принято выражать с помощью мицеллярных формул. Ниже приведен пример мицеллярной формулы золя AgI, полученного по реакции
AgNO3 + KI = AgI + KNO3 при избытке KI:
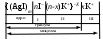
Следует отметить, что состав мицеллы может изменяться как количественно, так и качественно при изменении состава среды. Так, если бы в приведенном выше примере средой был бы раствор нитрата серебра (при избытке AgNO3), мицелла имела бы следующую формулу:

Контрольные вопросы
1. Что такое золь?
2. Какие условия нужны для получения лиофобного золя?
3. Какими методами обычно получают лиофобные золи?
4. Что такое физическая и химическая конденсация?
5. Какова основная особенность лиофобных дисперсных систем?
6. Какие возникают на поверхности коллоидной частицы?
7. Какие существуют варианты образования двойного электрического слоя?
8. Какова структура двойного электрического слоя?
9. Как изменяется потенциал ДЭС с расстоянием от поверхности?
10. Какие явления называются электрокинетическими и в чем их сущность?
11. Что такое электрокинетический потенциал, и от каких параметров зависит его величина?
12. По какому уравнению можно определить значение электрокинетического потенциала на основании изучения процессов электроосмоса или электрофореза?
13. Что вызывает коагуляцию лиофобных золей?
14. Что называется порогом коагуляции?
15. Какова формулировка и математическая запись правила Шульце-Гарди?
16. Каково строение мицеллы?
Лабораторная работа № 23. Получение лиофобных золей
Цель работы. Получить лиофобные золи. Составить формулу мицеллы.
Сущность метода. По заданию преподавателя получить лиофобный золь методом изиической или химической конденсации и определить коагулирующее действие различных электролитов.
Оборудование и реактивы. Колбонагреватель; цилиндр мерный объемом 200 мл – 1 шт.; колба мерная объемом 200 мл – 6 шт.; капельница – 3 шт.; химический стакан 250-300 мл – 6 шт.; мерная пипетка объемом 20 мл – 2 шт.; мерная пипетка объемом 15 мл – 1 шт.; пипетка мерная объемом 10 мл – 1 шт.; пипетка мерная объемом 5 мл – 1 шт.; пипетка градуированная (или бюретка) объемом 10 мл – 1 шт.; пипетка градуированная объемом 5 мл – 3 шт.; пипетка градуированная объемом 1 мл – 4 шт.; хлорид железа (III) – раствор концентрацией 10 %; хлорид железа (III) – насыщенный раствор; гексацианоферрат (II) калия – раствор концентрацией 20 %; сульфат кобальта – раствор концентрацией 0,1 %; сульфат меди (II) – раствор концентрацией 10 %; тиосульфат натрия – 0,05 н. раствор; ортофосфорная кислота – разбавленная 1:50; карбонат аммония – раствор, концентрацией 20 %; хлорид алюминия – раствор, концентрацией 30 %; хлорид хрома (III) – раствор, концентрацией 2 %.
Выполнение работы
Золь гидроксида железа (III). В круглодонную колбу объемом 250 – 300 мл мерным цилиндром отмерить 200 мл дистиллированной воды, поместить колбу с водой на колбонагреватель, довести до кипения и при помощи мерной пипетки добавить постепенно при перемешивании 10 мл раствора хлорида железа (III) концентрацией 10 %. При этом хлорид железа энергично гидролизуется по трем ступеням. Молекулы гидроксида железа конденсируются в коллоидные частицы. Образуется золь Fe(OH)3 красного цвета.
Золь берлинской лазури (положительный). 1 мл раствора K4[Fe(CN)6] концентрацией 20 % поместить в колбу объемом 200 мл и довести дистиллированной водой до метки. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл. К полученному раствору добавить при перемешивании 1 – 2 капли насыщенного раствора хлорного железа. Образуется прозрачный синего цвета золь берлинской лазури – гесациоаноферрат (II) железа (III).
Золь берлинской лазури (отрицательный). Градуированной пипеткой объемом 1 мл отобрать 0,2 мл насыщенного на холоде раствора хлорида железа (III), поместить в мерную колбу объемом 200 мл и довести до метки дистиллированной водой. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл. К полученному раствору при перемешивании стеклянной палочкой прибавить 1 – 2 капли раствора K4[Fe(CN)6] концентрацией 20 %.
Золь гексацианоферрата (II) кобальта (II). 1 мл раствора K4[Fe(CN)6] концентрацией 20 % поместить в колбу объемом 200 мл и довести дистиллированной водой до метки. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл. При помощи градуированной пипетки или бюретки объемом 10 мл медленно прибавить 6 – 7 мл раствора сульфата кобальта концентрацией 0,1 %. Образуется золь гексацианоферрата (II) кобальта (II) зеленого цвета.
Золь гексацианоферрата (II) меди (II). 1 мл раствора K4[Fe(CN)6] концентрацией 20 % поместить в колбу объемом 200 мл и довести дистиллированной водой до метки. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл и добавить при перемешивании 3 – 4 капли раствора сульфата меди (II). Образуется золь гексацианоферрата (II) меди (II) красно-бурого цвета.
Гидрозоль серы (зависимость окраски от степени дисперсности). В пробирку мерной пипеткой отобрать 15 мл 0,05 н. раствора тиосульфата натрия и при помощи мерной пипетки добавить 5 мл раствора ортофосфорной кислоты. Перемешать. По реакции 3Na2S2O3 + 2H3PO4 = 2Na3PO4 + 3S + 3SO2 + H2O образуется отрицательно заряженный золь, частицы которого в указанном растворе самопроизвольно укрупняются. В результате при интенсивном освещении пробирки с золем можно наблюдать постепенное изменение его окраски от желтой до голубой, затем происходит его явная коагуляция.
Золь гидроксида алюминия. В мерную колбу объемом 200 мл мерной пипеткой отобрать 20 мл раствора карбоната аммония концентрацией 20%, довести дистиллированной водой до метки. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл. К раствору добавить при перемешивании 0,4 мл раствора хлорида алюминия концентрацией 30 %. Образуется бесцветный опалесцтрующий золь гидроксида алюминия.
Золь гидроксида хрома (III). В мерную колбу объемом 200 мл мерной пипеткой отобрать 20 мл раствора карбоната аммония концентрацией 20%, довести дистиллированной водой до метки. Колбу плотно закрыть пробкой. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. Раствор перелить в химический стакан объемом 250 – 300 мл. К раствору добавить при перемешивании 4 мл раствора соли хрома (хлорида или сульфата). Образуется мутно-зеленый золь гидроксида хрома (III).
Содержание протокола лабораторной работы
1. Указать использованные реактивы и оборудование
2. Записать наблюдения при получении золей и при их стоянии во время занятия
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных: уравнения реакций в молекулярной и ионной формах, формулы мицелл; какие ионы будут обладать наибольшим коагулирующим действием в каждом случае?
