Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 515
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
6. В химический стакан объемом 500 мл с серной кислотой опустить две бюретки с краном и графитовые электроды так, как показано на рис. 8. При помощи груши заполнить бюретки 1 н. раствором серной кислоты до середины бюретки и отметить уровень жидкости в каждой бюретке. Краны бюреток закрыть.
7. Оформить установку в соответствии с рис. 8.
8. Включить ток при максимальном сопротивлении реостата.
9. Установить значение силы тока 7 - 10 А.
10. Вести электролиз в течение часа.
11. Выключить ток.
12. Открыть кран электролитического мостика.
13. При помощи мерного цилиндра измерить объем жидкости в катодном и анодном пространстве (стакан объемом 50 мл № 1).
14. Из катодного пространства мерной пипеткой объемом 20 мл в две конические колбы объемом 250 мл отобрать 2 пробы.
15. К пробам добавить по 4 капли фенолфталеина.
16. Оттитровать пробы 0,02 н. раствором гидроксида натрия.
17. Из анодного пространства мерной пипеткой объемом 20 мл в две конические колбы объемом 250 мл отобрать 2 пробы.
18. К пробам добавить по 4 капли фенолфталеина.
19. Оттитровать пробы 0,02 н. раствором гидроксида натрия.
Содержание протокола лабораторной работы
Электролит _______________.
Исходная концентрация электролита C0 = ______ н.
Температура Т = ________°С.
Атмосферное давление Ратм = _________ мм рт. ст.
Объем 1 н. раствора серной кислоты в бюретках до начала электролиза
V1 = ________ мл; V2 = ________ мл;
Сила тока __________ А
Продолжительность электролиза _____ мин.
Уровень 1 н. раствора серной кислоты в бюретках по окончании электролиза
V*1 = ________ мл; V*2 = ________ мл;
h1 = ________ мм; h2 = ________ мм
Концентрация титранта (гидроксида натрия)
CT = ________ н.
Объем раствора в катодном пространстве
VK = __________ мл
Объем пробы, взятой для анализа Va,K = ______ мл
Объем титранта
Средний объем титранта
Объем раствора в анодном пространстве VА = __________ мл
Объем пробы, взятой для анализа
Va,A = ______ мл
Объем титранта
Средний объем титранта
Обработка результатов эксперимента
Вычислить равновесную концентрацию электролита в катодном пространстве:
Вычислить равновесную концентрацию электролита в анодном пространстве:
Вычислить убыль вещества в катодном пространстве:
Вычислить прибыль вещества в анодном пространстве:
Вычислить объем выделившегося кислорода:
Рассчитать давление газа в бюретке:
где
Вычислить количество эквивалентов газа, которое соответствует количеству электричества, прошедшего через раствор, т.к. 1 фарадей электричества переносит 1 эквивалент вещества:
где n – согласно закону эквивалентов – количество вещества, разложившееся под действием заданного количества электричества
Давление газа следует перевести в Па (760 мм рт.ст. = 1,013·105Па), объем газа – в м3 (1 мл = 10−6 м3).
Рассчитать число переноса сульфат-иона:
.
Проверить правильность определения чисел переноса:
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Термодинамика электрохимических систем
Краткие теоретические сведения
К электрохимическим будем относить процессы, сопровождающиеся переносом заряда, образованием двойного электрического слоя (ДЭС) и идущие на поверхности раздела фаз. Такой комплекс процессов, как правило, сопровождается взаимным превращением электрической энергии в химическую в результате протекания окислительно-восстановительных реакций.
Электрохимический потенциал возникает на поверхности раздела фаз электрод – раствор. Причиной образования электродного потенциала является появление на поверхности электрода двойного электрического слоя, который можно сравнить с плоским конденсатором, одной обкладкой которого служит заряженная поверхность металла, а другой – внешняя граница ДЭС. В простейшем случае двойной электрический слой состоит из слоя потенциалопределяющих ионов, расположенных непосредственно на поверхности электрода и слоя противоионов, которые соединены с потенциалопределяющими ионами за счет сил электростатического взаимодействия.
Непосредственно измерить потенциал какой-либо системы пока не представляется возможным. Мы можем измерить только разность потенциалов или электродвижущую силу (ЭДС) гальванической системы, состоящей из пары электродов – электрохимической цепи. С другой стороны, потенциал электрода зависит от температуры и концентрации раствора. В связи с этим было введено понятие стандартного водородного электрода и шкалы стандартных электродных потенциалов. Потенциал стандартного водородного электрода условно принят равным нулю и относительно него считаются потенциалы всех возможных электродных систем, приведенные к единым условиям, получивших название стандартных: температура 298 K и концентрация раствора 1 моль/кг (если речь идет о газовых электродных системах, то давление газа – 1 атм).
Зависимость потенциала электрода от температуры и состава раствора относительно значения стандартного электродного потенциала была выведена Нернстом для окислительно-восстановительного процесса, протекающего на поверхности электрода
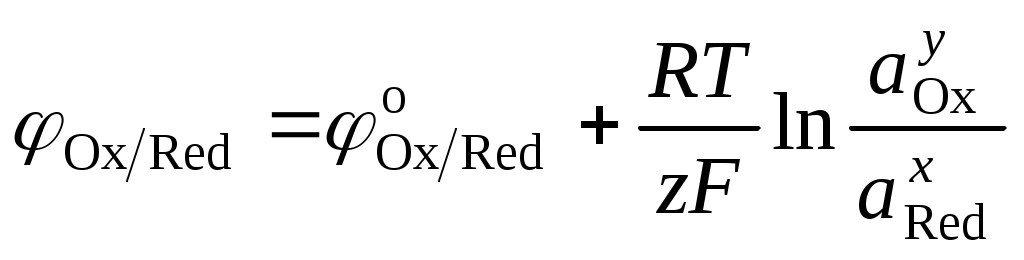
,
где
При схематической записи электрохимических систем, а также уравнений протекающих в них реакций необходимо соблюдать следующие основные правила. Для электродов (полуэлементов) вещества, находящиеся в растворе, указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или электродный материал. Если одна фаза содержит несколько веществ, то их символы разделяются запятыми:
Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме, например: Cu2+ + 2e = Cu0; 2H+ + 2e = H2; Fe3+ + e = Fe2+.
Принять различать 4 типа электродных систем.
Электроды 1 рода образованы простым веществом (металлом или неметаллом), погруженным в раствор своей соли. Металлическому электроду Меz+|Ме соответствует реакция Меz+ + ze = Me и потенциал электрода описывается уравнением:
Примерами электрода первого рода могут быть медный электрод Cu2+|Cu (CuSO4|Cu), цинковый электрод Zn2+|Zn (ZnSO4|Zn) и др.
Неметаллическому электроду Az|A соответствует электродная реакция A + ze = Az и потенциал электрода описывается уравнением:
Потенциал электрода первого рода зависит от активности лишь одного сорта ионов.
Электроды 2 рода состоят из металла
