Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 532
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
9. Получить еще 10 показаний при постоянной температуре (конечный период).
Содержание протокола лабораторной работы
Название слабой кислоты и ее химическая формула
Концентрация раствора серной кислоты Ск
Масса стеклянной палочки, г
Масса внутреннего стакана калориметрической установки mстакана, г
Масса стакана с раствором mстакана с раствором, г
Масса раствора mр-ра, г
Масса пипетки mпипетки, г
Масса пипетки со щелочью mпипетки с раствором, г
Масса щелочи mщ, г
Объем раствора щелочи Vщ, мл
Концентрация раствора щелочи Сщ, моль/л
Объем ртутного баллона термометра VHg, мл
Измерения температуры (таблица).
| Время, с | Температура,Б | Время, с | Температура,Б | Время, с | Температура,Б |
| Начальный период | Главный период | Конечный период | |||
| | | | | | |
Обработка результатов эксперимента
1. Построить график зависимости Т = f(τ), отражая показания температуры по начальному и конечному периодам.
2. Соединить последнюю точку начального периода с начальной точкой конечного периода.
3. Полученную линию разделить пополам.
4. Через точку середины провести перпендикуляр к оси абсцисс.
5. Продлить температурные зависимости начального и конечного периодов до пересечения с перпендикуляром – получим значение изменения температуры Т.

6. Рассчитать теплоемкость калориметрической установки по уравнению:
Сcal = Cр-р(mp-p + mщ) + СHgVHg + Cстm, Дж/К,
где Cр-р – удельная теплоемкость раствора, 4,18 Дж/гК; mp-p – масса раствора во внутреннем стакане, г; mщ – масса раствора щелочи в пипетке, г; СHg – объемная теплоемкость ртути и стекла, 1,92 Дж/см
3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; m – общая масса стеклянных частей калориметрической установки, г.
7. Вычислить тепловой эффект процесса нейтрализации по уравнению:
где nщ – количество вещества щелочи в пипетке, моль.
8. Пользуясь справочными данными рассчитать
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Коллигативные свойства растворов
Краткие теоретические сведения
Коллигативные свойства раствора зависят только от концентрации растворенного вещества. К коллигативным свойствам относятся понижение давления насыщенного пара растворителя, повышение температуры кипения раствора, понижение температуры замерзания и осмотическое давление.
Давление насыщенного пара растворителя над раствором всегда меньше, чем давление насыщенного пара растворителя над ним самим:
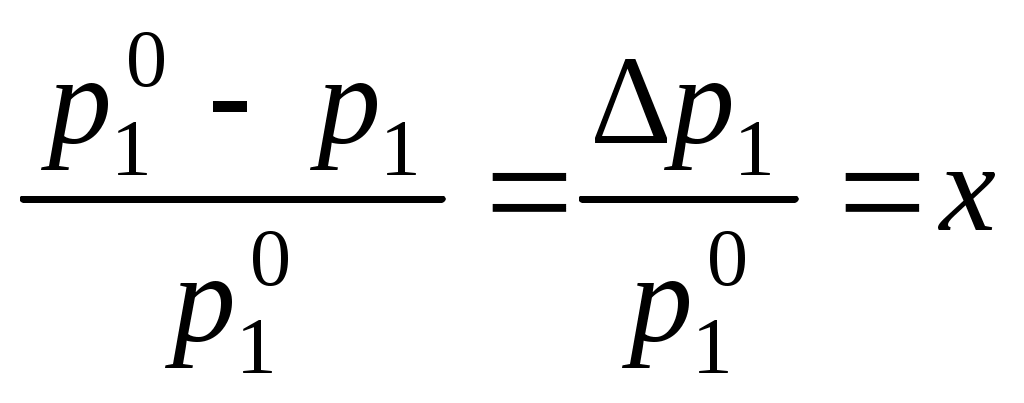 ,
,где p1 – давление насыщенного пара растворителя над раствором,
Раствор всегда кипит при температуре, большей, чем чистый растворитель:
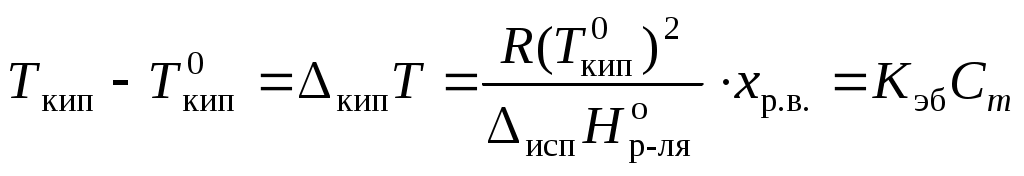 ,
, где Ткип – температура кипения раствора;
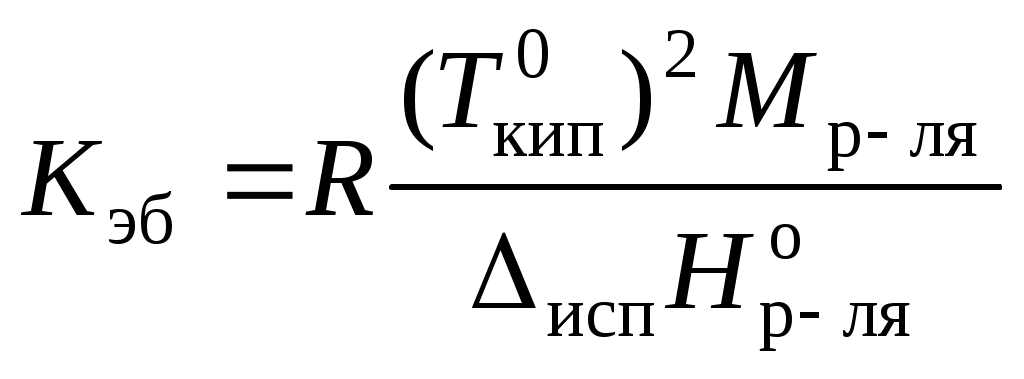 ,
, где Мр-ля – молярная масса растворителя, кг/моль.
Раствор замерзает при температуре меньшей, чем чистый растворитель:
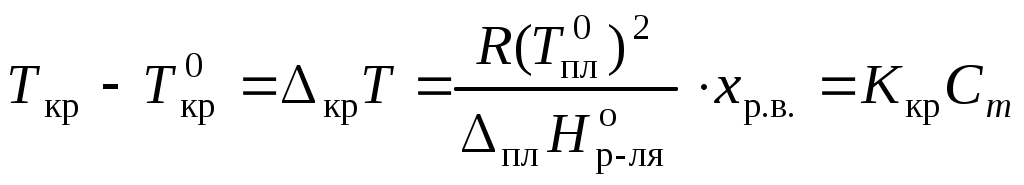 ,
,где Ткр – температура кристаллизации раствора
;
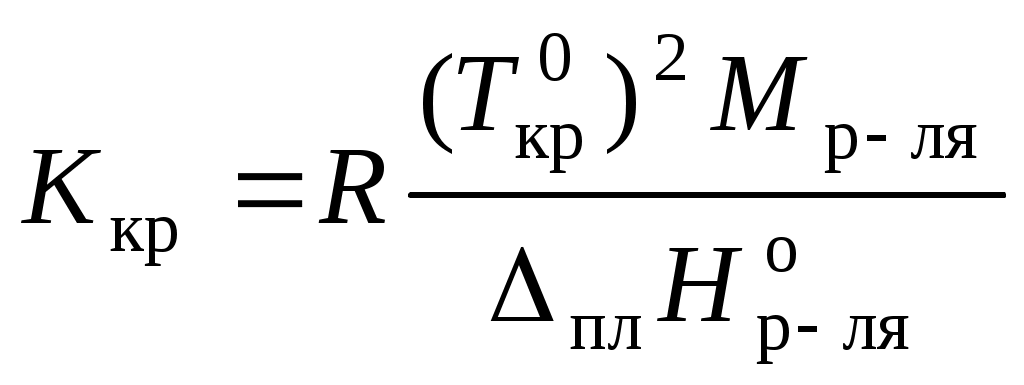 .
.Например, для воды криоскопическая постоянная равна 1,86 K·кг/моль, для бензола – 5,07, диоксана – 4,71 и т.д.
Осмотическое давление:
где R – универсальная газовая постоянная; Т – температура; xр.в. – мольная доля растворенного вещества; СМ – молярная концентрация раствора;
Коллигативные свойства определяются свойствами чистого растворителя и не зависят от свойств растворенного вещества.
Для того, чтобы сделать существующие уравнения пригодными для расчетов растворов электролитов, Вант-Гофф ввел в них множитель i, названный изотоническим коэффициентом. Изотонический коэффициент является показателем увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). Значение i >1 свидетельствует о наличии процесса диссоциации, а i < 1 – о процессе ассоциации. С учетом изотонического коэффициента для растворов электролитов получим:
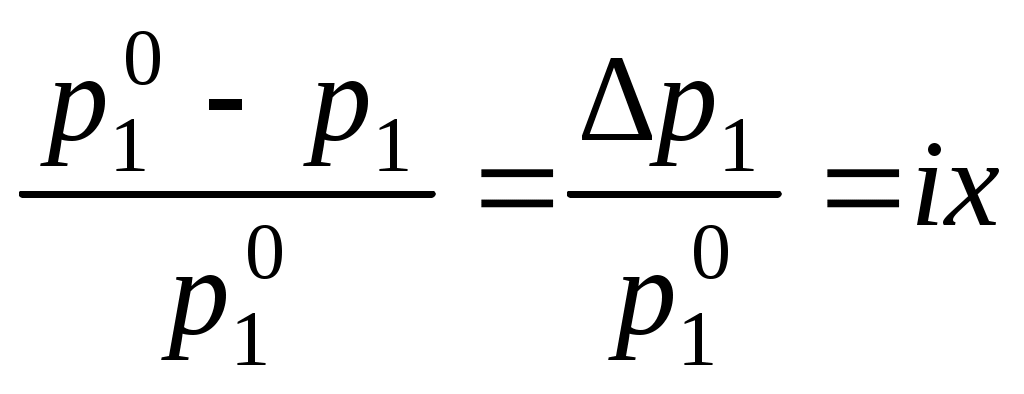 ,
,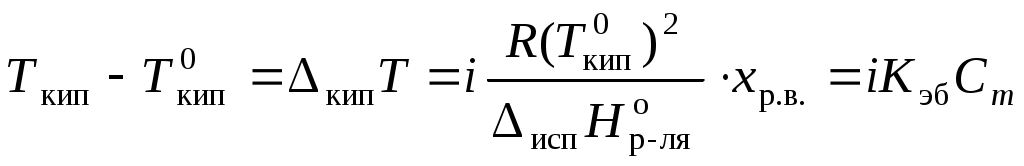 ,
,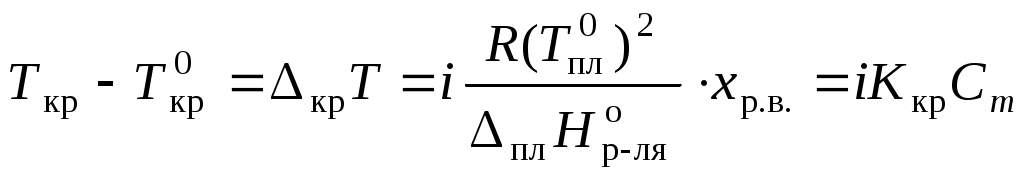 ,
,Численное значение изотонического коэффициента позволяет для случая диссоциации вычислить степень диссоциации :
для случая ассоциации вычислить степень ассоциации :
,
где
Коллигативные свойства растворов используются для определения молярной массы растворенных веществ, а также для определения изменения состояния вещества в растворе по сравнению с чистым веществом.
Контрольные вопросы
1. Какие свойства растворов называются коллигативными?
2. От величины какого параметра системы зависит значение коллигативного свойства?
3. На каких основных положениях основана теория коллигативных свойств растворов?
4. Как изменяется давление насыщенного пара растворителя при переходе от числого растворителя к раствору?
5. Как изменение давления насыщенного пара растворителя связано с концентрацией раствора?
6. Как сказывается изменение концентрации раствора на его температуре кипения?
7. Какое уравнение отображает зависимость температуры кипения раствора от концентрации растворенного вещества?
8. Как сказывается изменение концентрации раствора на его температуре кристаллизации?
9. Какое уравнение отображает зависимость температуры кристаллизации раствора от концентрации растворенного вещества?
10. Каким уравнением связаны криоскопическая постоянная растворителя и его термодинамические характеристики?
11. Каким уравнением связаны эбуллиоскопическая постоянная растворителя и его молярная масса?
12. Что такое осмотическое давление?
13. Каким уравнением описывается зависимость осмотического давления от концентрации раствора?
14. Свойствами какого компонента раствора определяются коллигативные свойства?
15. С какой целью в уравнения коллигативных свойств растворов был добавлен изотонический коэффициент?
16. Что показывает изотонический коэффициент?
17. Как изотонический коэффициент связан со степенью диссоциации или ассоциации вещества в растворе?
18. Какие свойства системы могут быть определены на основании измерения коллигативных свойств?
