Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 531
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
= объем катионита;
= объем аликвоты при титровании раствора соли металла Va = 5 мл;
= Объем раствора трилона Б, израсходованного на титрование исходного раствора
VТ,1 = ………….мл
VТ,2 = ………….мл
VТ, ср = ………….мл
= концентрация раствора трилона Б
Таблица экспериментальных данных
| № | τ, мин | Объем трилона Б, мл | |
| VT,1 | VT,2 | ||
| Исх. | 0 | | |
| 1 | 3 | | |
| 2 | 6 (3+3) | | |
| 3 | 9 (3+3+3) | | |
| … | … | | |
Обработка результатов эксперимента
По данным п. 8 заполнить таблицу:
| z номер пробы | τ, мин | Сz | , % | nτ, моль | zVпр | Сτ, моль/л | −ln(Cτ/C0) | | |
| | | С0 | - | | − | | - | - | - |
| 1 | 2 | С1 | α1 | | 10 | | | | |
| 2 | 4 | С2 | α2 | | 20 | | | | |
| 3 | 6 | С3 | α3 | | 30 | | | | |
| … | … | … | … | | ….. | | | | |
| 10 | | C10 | | | | | | | |
α − текущая степень очистки воды, которую вычислить по уравнению
где Сz – текущая концентрация катиона металла в растворе, моль/л; С0 – исходная концентрация катиона металла в растворе, моль/л.
Концентрации катиона металла (С0 и Сz) в растворе вычислить по формуле:
где СТ – концентрация трилона Б (0,05 моль/л); VТ – эквивалентный объем трилона Б, мл; Va – объем пробы, взятый для определения концентрации катиона металла, мл, Va = 5 мл.
Сτ − текущая концентрация соли металла в пробе, приведенная к исходному объему, моль/л, которую вычислить по формуле:
где nτ – количество моль катионов металла, оставшихся в растворе на текущий момент времени, nτ рассчитывается по формуле:
где Vпр – объем пробы, отобранный для последующего определения концентрации катиона металла, Vпр = 10 мл; z – номер пробы.
Построить зависимость концентрации соли металла от продолжительности перемешивания Сz = f(τ).
Построить зависимость степени очистки воды от продолжительности перемешивания α = f(τ).
Вычислить величину статической обменной емкости:
где VK – объем катионита, м3; n∞ − количество молей катионов металла, оставшихся в растворе на момент равновесия,
Построить зависимость ln(C0/Cτ) = f(τ).
Построить зависимость
Определить характер лимитирующей стадии процесса.
При прямолинейной зависимости ln(C0/Cτ) = f(τ) стадией, определяющей скорость процесса обмена ионов, является диффузия обменивающихся ионов в тонком слое раствора в непосредственной близости от зерна ионита («пленочная кинетика» или внешнедиффузионная кинетика). Кинетическая зависимость процесса адсорбции в этом случае подчиняется уравнению первого порядка. В данном случае можно константа скорости реакции ионного обмена соответствует тангенсу угла наклона зависимости ln(C0/Cτ) = f(τ).
При прямолинейной зависимости
8. Определить константу скорости процесса ионного обмена.
=Для графика ln(C0/Cτ) = f(τ) или
= Выбрать на графике две точки подальше друг от друга.
= По осям координат определить значения ln(C0/Cτ) (или
=
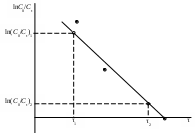
Рис. 17. Обработка графической зависимости ln(C0/Cτ) = f(τ)
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа №22. Разделение меди и цинка на катионите
Цель работы: разделить катионы меди и цинка при помощи колонки с катионитом и проанализировать их содержание в растворе
Сущность работы: для разделения меди и цинка используют различие в их десорбции оксалатом аммония после поглощения катионитом. Ионы меди удаляются из колонки в виде оксалатного комплекса.
Оборудование и реактивы. Колонка с катионитом; кондуктометр; штатив с лапками; магнитная мешалка; мерный цилиндр объемом 25 мл – 2 шт.; химический стакан объемом 500 мл – 1 шт; химический стакан объемом 250 мл – 1 шт.; химический стакан объемом 150 мл – 1 шт.; химический стакан объемом 50 мл – 3 шт; бюретка объемом 25 мл – 1 шт; пипетка мерная объемом 10 мл – 1 шт.; гидроксид натрия – 0,1 н. раствор; серная кислота – 3 н. раствор; раствор, содержащий смесь сульфата меди и сульфата цинка.
Выполнение работы
I. Разделить катионы меди и цинка
1 Слить воду и промыть колонку 1 объемом 3 н. H2SO4, или HCl. Фильтрат – выбросить.
2. Отмыть колонку от избытка кислоты дистиллированной водой до нейтральной реакции по метиловому-оранжевому (пропустить через колонку около 56 объемов Н2О). Промывные жидкости – выбросить.
3. Пробу задачи объемом 20 мл поместить в ионообменную колонку.
4. Открыть кран колонки и пропустить через нее раствор со скоростью 1-2 капли в секунду. Фильтрат – выбросить.
5. Промыть колонку дистиллированной водой до нейтральной реакции по метиловому-оранжевому (пропустить через колонку около 5 объемов Н2О). Фильтрат – выбросить.
6. Провести отделение ионов меди пропустить через колонку 20 мл оксалата аммония. Фильтрат собрать в маркированный стаканчик и оставить для анализа содержания меди.
7. Промыть колонку 1 объемом дистиллированной воды. Фильтрат – выбросить.
II. Анализ содержания меди методом кондуктометрического титрования.
1. При помощи мерной пипетки отобрать пробу для титрования в химический стакан объемом 150 – 200 мл.
2. В бюретку залить раствор щелочи и «занулить».
3. Стакан с пробой поставить на магнитную мешалку.
4. Поместить в стакан якорь для перемешивания.
5. Опустить в стакан с пробой электрод для измерения электропроводности.
Электрод следует опустить максимально низко, однако он не должен мешать перемешиванию раствора. Щель электрода должна быть закрыта раствором. Для этого следует добавить дистиллированную воду.
6. Собрать установку для проведения титрования
7. Включить кондуктометр.
8. Запустить магнитную мешалку.
9. Записать значение электропроводности на экране прибора, не забыв отметить единицы измерения.
10. Титровать пробу кислоты с шагом 0,5 мл, фиксируя значение электропроводности после добавления каждой порции титранта.
11. Титрант добавлять до получения перегиба зависимости χ = f(VT).
12. После перегиба следует получить еще 5-7 точек.
13. Результаты измерений заносят в таблицу.
Содержание протокола лабораторной работы
1. № задачи
2. Объем пробы, взятый для титрования Va = ……..мл
3. Концентрация титранта С(NaOH) = ……………..экв/л
4. Таблица экспериментальных данных
Данные для построения кривой кондуктометрического титрования
| № п/п | VNaOH, мл | Удельная электропроводность , См |
| 1 | 0 | |
| 2 | 0,5 | |
| 3 | 1 | |
| … | … | |
Обработка результатов эксперимента
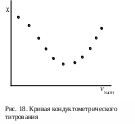
1. По данным таблицы построить кривую кондуктометрического титрования, которая будет иметь вид, показанный на рис. 1.
2
. Обработать графически кривую титрования, как показано на рис. 2.
3
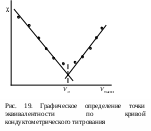
. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи (см. рис. 2а, 2б).
4. Точное значение концентрации электролита вычислить по формуле:
