Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 383
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
Оборудование и реактивы. Круглодонная колба объемом 100 мл; дефлегматор длиной 100 мм; насадка Вюрца; холодильник Либиха, длиной 300 мм; алонж; мерный цилиндр объемом 15 – 25 мл – 3 шт.; мерный цилиндр объемом 50 – 100 мл; пробирка – 1 шт.
Выполнение работы
1. Получить у преподавателя состав изучаемой системы.
2. Определить компоненты «А» и «В». За компонент «А» обычно принимают более летучее вещество.
3. В сухой колбе с притертой пробке объемом 100 мл приготовить растворы выбранных компонентов общим объемом 50 мл с содержанием вещества «В»: 40, 50, 60 или 70 % (об.).
| № | 4 | 5 | 6 | 7 |
| Φ(В), % | 40 | 50 | 60 | 70 |
| VA, мл | 30 | 25 | 20 | 15 |
| VB, мл | 20 | 25 | 30 | 35 |
4. Собрать установку (см. рис. 4), в которой в качестве приемка используется мерный цилиндр объемом 15-25 мл.
5. Поместить в перегонную колбу 60 мл исследуемой смеси.
Когда начинается отгонка жидкости, а температура установится постоянной, производится построение кривой разгонки в координатах: объем отгона – температура (см. рис. 5).
6. Собрать первую фракцию разгонки. Температуру кипения записывать после сбора каждых 2 мл дистиллята. Нормальная скорость перегонки – 1 капля за 2 секунды.
7. Когда температура кипения начнет быстро повышаться. Быстрое повышение температуры означает ее подъем на 5 – 7°С в течение 10 – 20 с. Сменить приемник и собрать вторую фракцию во время быстрого повышения температуры отходящих паров. Температуру кипения записывать после сбора каждых 2 мл дистиллята. Нормальная скорость перегонки – 1 капля за 2 секунды.
8. С момента прекращения быстрого роста температуры сменить приемник и до конца перегонки собрать третью (окончательную) фракцию.
9. Когда в перегонной колбе останется 3 – 5 мл жидкости, мерный цилиндр заменить чистой и сухой пробиркой и собирать в нее остаток третьей фракции. Этот отгон впоследствии используют для определения плотности и показателя преломления.
10. Когда в перегонной колбе останется 2 – 3 мл жидкости перегонку остановить: убрать нагревательный прибор от перегонной колбы.
Насухо перегонять вещество из колбы нельзя, т.к. последние капли вещества, сконцентрировавшиеся в дефлегматоре (флегма), попадая на сухое дно колбы, могут вызвать ее растрескивание.
11. После завершения разгонки измерить объемы всех трех фракций.
Если объем средней фракции превысит 3 – 4 мл (что бывает обычно при форсированной перегонке), то ее надо перегнать повторно, но в более медленном темпе с целью выделения дополнительного количества первой и третьей фракций.
12. Высушить весь прибор, поместить в перегонную колбу первую фракцию, отогнать и выбросить первый 1 мл отгона, затем медленно отогнать еще 3 – 5 мл вещества с целью определения плотности и показателя преломления первого компонента.
Содержание протокола лабораторной работы
Компонент «А»: наименование, химическая формула, плотность, показатель преломления, температура кипения.
Компонент «В»: наименование, химическая формула, плотность, показатель преломления, температура кипения.
Таблица экспериментальных данных
| Первая фракция | Вторая фракция | Третья фракция | |||
| Объем | Температура, °С | Объем | Температура, °С | Объем | Температура, °С |
| 2 | | 2 | | 2 | |
| 4 | | 4 | | 4 | |
| …. | | … | | … | |
Объем первой фракции V1 = …… мл.
Объем второй фракции V2 = …… мл.
Объем третьей фракции V3 = ……. мл.
Обработка экспериментальных данных

1. По данным таблицы экспериментальных данных построить кривую разгонки в координатах
Т,°С – объем отгона, мл.
2. По ординатам горизонтальных участков полученной кривой разгонки определить температуры кипения компонентов.
3. По количествам отогнанных фракций определить количественное соотношение компонентов в смеси (в объемных долях).
4. Составить материальный баланс разгонки, используя данные об исходном составе системы. В общем материальном балансе должны указываться и неизбежные при разгонке потери.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Цель работы: построить диаграммы состояния «жидкость-пар» для двухкомпонентной системы, состоящей из двух легко кипящих жидкостей.
Сущность метода. Для построения диаграммы состояния в данном случае используется аналитический метод. В ходе эксперимента следует измерить температуры кипения смесей различного состава бинарной системы при атмосферном давлении, определить равновесные концентрации пара и жидкости для каждой смеси рефрактометрическим методом и построить диаграммы состояния системы в координатах температура — состав и состав пара — состав жидкости.
Для работы используются системы, в которых оба компонента значительно отличаются по температуре кипения (при наличии азеотропных смесей это не столь существенно) и по показателю преломления. Например: бензол – ацетон; бензол – хлороформ; дихлорэтан – толуол; четыреххлористый углерод – ацетон; ацетон – хлороформ; пропиловый спирт – четыреххлористый углерод; этиловый спирт – вода; четыреххлористый углерод – этиловый спирт; этиловый спирт – бензол. Ниже приведены характеристики перечисленных веществ.
| Вещество | Химическая формула | Ткипения, °С | Показатель преломления | Плотность, d20 г/см3 |
| Бензол | С6Н6 | 80 | 1,5011 | 0,8790 |
| Ацетон | СН3СОСН3 | 56 | 1,3588 | 0,7905 |
| Хлороформ | СНСl3 | 61 | 1,4449 | 1,489 |
| 1,2-Дихлорэтан | CH2ClCH2Cl | 83 | 1,4448 | 1,2570 |
| Толуол | C6H5CH3 | 111 | 1,4969 | 0,8670 |
| Четыреххлористый углерод | CCl4 | 77 | 1,4603 | 1,5940 |
| Пропиловый спирт | CH3CH2CH2OH | 97 | 1,3853 | 0,8040 |
| Этиловый спирт | CH3CH2OH | 78 | 1,3611 | 0,7893 |
| Вода | H2O | 100 | 1,3330 | 0,9982 |
| | | | | |
Оборудование и реактивы. Рефрактометр; штатив с лапками и кольцом; штатив для пробирок; спиртовка; круглодонная двугорлая колба объемом 100 мл (или круглодонная колба объемом 100 мл с двурогим форштоссом); холодильник Либиха длиной 30 см; алонж; мерный цилиндр объемом 50 мл – 2 шт., плоскодонные колбы с притертой пробкой объемом 50 мл – 4 шт.; пробирки с пробками – 8 шт.
Выполнение работы
1. Получить у преподавателя состав изучаемой системы.
2. Определить компоненты «А» и «В». За компонент «А» обычно принимают более летучее вещество.
3. В четырех сухих колбах с притертыми пробками объемом 50 мл приготовить растворы выбранных компонентов общим объемом 40 мл с содержанием вещества «В»: 10, 20, 30, 40, 50, 60, 70, 80 и 90 % (об.).
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Φ(В), % | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| VA, мл | 36 | 32 | 28 | 24 | 20 | 16 | 12 | 8 | 4 |
| VB, мл | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 |
4. При помощи рефрактометра измерить показатели преломления всех приготовленных растворов. Данные измерений занести в таблицу экспериментальных данных.
По ниже описанной схеме определить температуры кипения всех приготовленных проб.
5. Раствор перелить в перегонную колбу.
6. Бросить в раствор «кипелки» – мелкие кусочки кирпича или неглазурованного фарфора.
7. Собрать установку, изображенную на рис. 6. Внимание! Термометр должен быть расположен на 1 см ниже горла с холодильником!
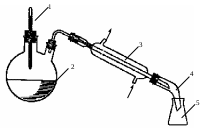
Рис. 6. Схема перегонной установки. 1 – термометр; 2 – перегонная колба; 3 – холодильник Либиха; 4 – алонж; 5 – приемник. Стрелками показано направление течения охлаждающей воды.


