Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 511
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
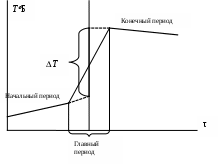
По завершении измерения начального периода приступают к выполнению главного периода: выливают раствор из пипетки, либо добавляют в реакционную систему сухое вещество. Главный период сопровождается значительным изменением температуры и соответствует протеканию химической реакции. Продолжительность главного периода обычно составляет 1-3 мин. В ходе главного периода следует следить за показаниями термометра и фиксировать их по-прежнему через 30 с.
Заключительный период – система приходит в состояние равновесия. Наблюдается постоянство температуры, либо незначительный температурный ход, как в начальном периоде. Для определения температурного хода заключительного периода проводят измерения температуры при постоянном перемешивании в течение 5-6 мин. через каждые 30 с.
Для определения поправок на теплообмен и разности температур предлагается использовать графический метод, предложенный проф. К.П.Мищенко. В первой половине главного периода теплообмен продолжается с той же скоростью, что и в начальном периоде, а во второй – с той же скоростью, что и в конечном периоде. Величину Т определяют как разность между двумя температурами, которые имела бы система в случае мгновенного протекания реакции и в момент времени, соответствующий середине главного периода.
После определения Сcal и Т рассчитывают наблюдавшийся в реакции тепловой эффект и относят его к числу молей вещества, принявших в ней участие:
Для реакции нейтрализации используют число моль вещества, находившемуся в пипетке. Для реакций растворения тепловой эффект относят к числу молей растворенной соли.
Для реакции взаимодействия сильной кислоты со щелочью величина eqH является результатом трех последовательных процессов:
1) разбавления исходного раствора пробы до объема всей системы;
2) разбавление исходного раствора в стакане до объема всей системы;
3) собственно реакция нейтрализации:
Если пренебречь первыми двумя процессами (у нас растворы разбавленные и тепловой эффект от этих процессов незначителен), то теплота процесса должна быть близка к стандартной теплоте нейтрализации, вычисленной по закону Гесса.
При нейтрализации слабых кислот или оснований значение теплоты нейтрализации может существенно отличаться от стандартного, т.к. в этом случае процесс можно разделить на две стадии:
1) диссоциация слабого электролита и гидратация ионов:
2) собственно нейтрализация:
В данном случае тепловой эффект реакции является суммой указанных процессов:
В этом случае к теплоте нейтрализации сильного электролита
При растворении соли
Для реакции образования кристаллогидрата следует рассмотреть другой цикл. Например, для определения
и растворения кристаллогидрата
Если вычесть уравнение (**) из уравнения (*), то получим реакцию образования кристаллогидрата (гидратообразования)
где
Таким образом, искомый тепловой эффект реакции гидратообразования может быть определен как разность теплот растворения моля безводной соли и моля кристаллогидрата с образованием растворов одинаковой концентрации.
Контрольные вопросы
1. От каких параметров системы зависит тепловой эффект реакции и теплоемкость?
2. Из каких основных частей состоит простейшая калориметрическая система?
3. Что такое диатермическая оболочка калориметра. Ее особенности и отличие от адиабатической оболочки.
4. На каком законе термодинамики основано измерение теплового эффекта реакции?
5. Как в диатермических условиях изменяется энтальпия калориметрической системы?
6. Из каких составляющих складывается
7. Какие величины надо знать или экспериментально определить для установления теплового эффекта реакции?
8. Как можно определить теплоемкость системы? Недостаток расчетного метода.
9. Какие этапы можно выделить при проведении термохимических измерений? Краткая характеристика каждого этапа.
10. Какие составляющие входят в величину теплового эффекта реакции нейтрализации слабого электролита?
11. Как можно определить тепловой эффект процесса гидратообразования?
Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
Цель работы: определение теплового эффекта процессов растворения соли и гидратообразования.
Сущность работы: при растворении солей часто наблюдается экзо- или эндотермический эффект. Для определения теплового эффекта процесса гидратообразования необходимо знать теплоемкость системы и изменение температуры системы вызванное процессами растворения безводной соли и ее кристаллогидрата
Оборудование и реактивы.Стеклянный стакан объемом 500 мл – 1 шт. Фарфоровый или стеклянный внешний стакан объемом 750 мл – 1 шт. Стеклянная палочка для перемешивания – 1 шт. Кристаллизатор – 1 шт. Штатив с лапками – 1 шт. Термометр Бекмана – 1 шт. Мерный цилиндр объемом 100 мл (для определения объема ртутного баллона термометра Бекмана) – 1 шт. Мерный цилиндр объемом 500 мл – 1 шт. Секундомер – 1 шт. Весы лабораторные – 1 шт. Безводная соль (сульфат меди, никеля или магния). Кристаллогидрат этой соли.
Выполнение работы
1. Собрать калориметрическую установку.
2. Получить у преподавателя наименование соли, с которой будет выполняться эксперимент.
3. Решить задачу. Масса безводной соли 5 г. Какую массу будет иметь эквимолярное количество кристаллогидрата этой соли (можно проверить правильность решения у преподавателя)?
4. Отобрать навески безводной соли и кристаллогидрата.
5. Взвесить на технических весах стеклянный внутренний стакан и стеклянную палочку для перемешивания mст.
6. Определить объем ртутного баллона термометра. Для этого опустить нос термометра в мерный цилиндр объемом 100 мл, куда предварительно налито 50 мл воды и по разности уровней воды определить объем ртути, VHg.
7. Во внутренний стакан калориметрической установки поместить 300 мл (300 г) дистиллированной воды V и опустить в воду термометр Бекмана.
8. Пустить секундомер и через каждые 30 секунд записывать показания температуры (см. табл.) по термометру Бекмана в течение 5 минут (10 показаний) при постоянном перемешивании (начальный период).
9. Не прекращая отсчета времени и измерения температуры высыпать навеску безводной соли во внутренний стакан калориметра и размешать до полного растворения (главный период). По-прежнему через каждые 30 секунд записывать показания термометра Бекмана до установления постоянной температуры в калориметрической установке.
10. Получить еще 10 показаний при постоянной температуре как в п. 8 (конечный период).
11. Повторить п.п. 7 – 10 с кристаллогидратом данной соли.
Содержание протокола лабораторной работы
Название исследуемой соли и ее формула_________.
Формула кристаллогидрата__________.
Масса безводной соли
Масса кристаллогидрата (с решением задачи п. 3)
Масса стеклянного внутреннего стакана + масса стеклянной палочки mст = …, г.
Объем дистиллированной воды во внутреннем стакане
Объем ртутного баллона термометра Бекмана VHg, мл.
Масса раствора безводной соли
Масса раствора кристаллогидрата
Измерения температуры с кристаллогидратом:
| Время, с | Температура, Б | Время, с | Температура, Б | Время, с | Температура, Б |
| Начальный период | Главный период | Конечный период | |||
| | | | | | |
Обработка результатов эксперимента
При оформлении работы все расчеты производятся для каждого опыта отдельно, после чего берется среднее арифметическое значение для конечных результатов расчета.
1. Построить график зависимости Т = f(τ), отражая показания температуры по начальному и конечному периодам.
2. Соединить последнюю точку начального периода с начальной точкой конечного периода.
3. Полученную линию разделить пополам.
4. Через точку середины провести перпендикуляр к оси абсцисс.
5. Продлить температурные зависимости начального и конечного периодов до пересечения с перпендикуляром – получим значение изменения температуры Т.