Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 503
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
2. Какие параметры влияют на свойства гетерогенной однокомпонентной системы?
3. В каких координатах изображают диаграммы состояния гетерогенных однокомпонентных систем?
4. Как выглядит диаграмма состояния воды при низком давлении?
5. Сколько полей можно выделить на диаграмме состояния воды?
6. Какие фазы находятся в равновесии на линии ОА диаграммы состояния воды?
7. Какие процессы происходят на линии ОВ диаграммы состояния воды?
8. Какой процесс описывает линия ОС?
9. Что определяет наклон линий диаграммы?
10. Что такое точка безвариантного равновесия?
11. Каким уравнением описывается ход линий диаграммы?
12. Как выглядит дифференциальная форма уравнения Клаузиуса-Клапейрона?
13. Какую форму уравнения Клаузиуса-Клапейрона применяют для описания переходов между конденсированными фазами?
14. Какую форму уравнения Клаузиуса-Клапейрона применяют для описания процесса испарения?
15. Как изменяется теплота испарения при повышении температуры?
16. Каким уравнением описывается зависимость давления насыщенного пара от температуры?
17. Какие методы используются для измерения давления насыщенного пара?
Лабораторная работа №5. Давление насыщенного пара
Цель работы. Определить теплоту и энтропию испарения предложенной жидкости.
Сущность работы. Используя динамический метод измерения давления насыщенного пара, получают экспериментальную зависимость температуры кипения жидкости от давления. По экспериментальным данным строят зависимость в координатах lnp – 1/T. После математической обработки, вычисляют теплоту, изменение энтропии испарения жидкости и ее константу кипения (эбуллиоскопическую постоянную).
Оборудование и реактивы. Колбонагреватель, вакуумный насос, манометр, термометр со шлифом на температурный интервал от 0 до 150°С, колба круглодонная двугорлая объемом 100 мл, обратный шариковый холодильник (Аллина) длиной 25 см, склянка для промывания газов (Вульфа), колба круглодонная с длинным горлом, каплеуловитель, кран трехходовой – 1 шт., кран вакуумный трехходовой – 1 шт., трубка соединительная Т-образная – 3 шт.
Выполнение работы
1. В двугорлую колбу 6 отобрать 50 мл исследуемой жидкости (по заданию преподавателя).
2. Собрать установку, как показано на рисунке 3.
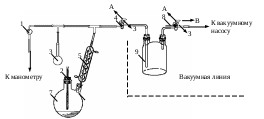
Рис. 3. Установка для измерения давления пара динамическим методом. 1 - каплеуловитель; 2 – круглодонная колба с длинным горлом; 3 – трубка соединительная Т-образная; 4 – обратный шариковый холодильник; 5 – термометр; 6 – двугорлая колба; 7 – трехходовой кран; 8 – трехходовой вакуумный кран; 9 – склянка Вульфа.
3. Трехходовой кран 7 поместить в положение «В»: система сообщается с вакуумной линией.
4. Трехходовой вакуумный кран 8 поместить в положение «В»: вакуумная линия сообщается с вакуумным насосом.
5. Включить вакуумный насос.
6. Создать разрежение в системе до давления, на 20 – 30 мм рт. ст. превышающего давление, при котором жидкость кипит при комнатной температуре.
7. Трехходовой кран 7 поместить в положение «З»: система отключена от вакуумной линии и от атмосферы.
8. Трехходовой вакуумный кран 8 поместить в положение «А»: вакуумная линия отключена от остальной системы и сообщена с атмосферой.
9. Выключить вакуумный насос.
10. Проверить герметичность установки: она считается достаточной, если за 10-15 мин давление в системе повысится не более чем на 1 – 2 мм рт. ст.
11. Подать воду в холодильник.
12. Включить колбонагреватель.
13. Отрегулировать скорость нагрева, которая должна составлять около 5°С/мин.
14. Когда жидкость закипит и в системе установится постоянная температура записать показания термометра и манометра в таблицу экспериментальных данных.
15. Трехходовой кран 7 осторожно поместить в положение «А» (система отключена от вакуумной линии и сообщается с атмосферой) и увеличить давление в системе на 20 – 30 мм рт. ст.
16. Трехходовой кран 7 поместить в положение «З».
17. Когда жидкость опять закипит и в системе установится постоянная температура записать показания термометра и манометра в таблицу экспериментальных данных.
18. Открыть трехходовой кран 7, увеличить давление в системе на 20 – 30 мм рт. ст. и получить новые данные по температуре кипения и давлению.
19. Выполнять п.п. 14-16 до давления в системе, равного атмосферному.
Всего в процессе эксперимента должно быть получено 15-20 данных по температуре кипения жидкости и давлению.
Содержание протокола лабораторной работы
Наименование исследуемой жидкости.
Химическая формула.
Температура плавления.
Температура кипения.
Плотность при обычных условиях.
Молярная масса.
Температура в помещении.
Атмосферное давление.
Таблица экспериментальных данных
| № п/п | Р, мм рт.ст. | Ткип, °С | Pкип, мм рт.ст. |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
| 5 | | | |
| … | | | |
Обработка экспериментальных данных
Заполнить таблицу:
| № п/п | Ткип, °С | Ткип, K | 1/T, K−1 | ркип, мм рт.ст. | | |
| 1 | | | | | | |
| 2 | | | | | | |
| 3 | | | | | | |
| 4 | | | | | | |
| 5 | | | | | | |
| … | | | | | | |
Построить графики зависимости
Обработать график зависимости, построенный в координатах
Определить значение теплоты испарения по формуле:
где b – величина углового коэффициента, R – универсальная газовая постоянная
Вычислить изменение энтропии в процессе испарения по уравнению:
где ΔvH – теплота испарения жидкости, определенная по результатам эксперимента, Дж/моль; Tv – температура кипения жидкости при атмосферном давлении, K.
Вычислить эбуллиоскопическую постоянную исследуемого вещества по уравнению:
 .
.Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Фазовые равновесия в двухкомпонентных системах
Краткие теоретические сведения
Свойства двухкомпонентных систем определяются тремя независимыми переменными: давлением Р, температурой Т (внешние переменные), а также составом системы при условии его выражения в долях или процентах (по массе или мольных). Двухкомпонентные системы условно разделяют на две категории: неконденсированные систем (газ − жидкость) и конденсированные (жидкость – кристаллы твердых фаз).
Основное уравнение, описывающее гетерогенные фазовые равновесия – уравнение правила фаз Гиббса записывается в следующем виде:
S = K – F + 2,
где S – число степеней свободы системы, т.е. число параметров состояния, которые можно изменять в определенных пределах без изменения фазового состава системы; K – число компонентов системы, т.е. минимальное число составных частей системы, необходимое для ее полного описания; F – количество фаз системы, т.е. число ее гомогенных частей, разделенных между собой поверхностями раздела.
Процессы, протекающие в двухкомпонентных системах, взаимное влияние температуры и состава на фазовые равновесия и др. принято отображать в виде диаграмм состояния. В большинстве случаев они строятся по экспериментальным данным, например, по кривым охлаждения. Наиболее распространены диаграммы состояния, характеризующие зависимость между исходным составом систем и температурой фазовых превращений, протекающих в этих системах. Изучение подобных диаграмм позволяет легко определить взаимную растворимость компонентов системы в различных агрегатных состояниях, наличие у них полиморфных превращений, состав и свойства химических соединений, образованных компонентами, температуру и давление всех фазовых превращений в системах заданного состава, изменение состава и относительного количества находящихся в равновесии фаз при изменении температуры или давления, выбрать состав наиболее легкоплавкой или тугоплавкой системы и т.д.
