Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 516
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
где VЭ – эквивалентный объем щелочи, определенный по кривой титрования, мл; СNaOH – концентрация раствора щелочи, экв./л; Va – объем пробы слабого электролита, мл.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Устойчивость дисперсных систем
Краткие теоретические сведения
Золи – это свободнодисперсные коллоидные системы с неупорядоченным расположением в пространстве частиц дисперсной фазы размером 10−5 – 10−7 см. Для получения лиофобных коллоидно-дисперсных систем необходимы три условия:
1) наличие взаимно нерастворимых веществ;
2) достижение необходимой степени дисперсности;
3) присутствие стабилизатора.
Необходимую степень дисперсности частиц можно достичь двумя методами: дисперсионным и конденсационным. Дисперсионный метод основан на измельчении дисперсной фазы механическим способом (в коллоидных мельницах, с помощью ультразвука, в пламени вольтовой дуги и т.п.) или методом пептизации – физико-химическим дроблением рыхлых осадков, в которых частицы дисперсной фазы разделены прослойками дисперсионной среды. Перевести такой осадок в коллоидный раствор можно создавая условия для появления сил взаимного отталкивания частиц осадка друг от друга.
Конденсационный метод основан на укрупнении частиц, агрегации молекул или ионов в истинных растворах в более крупные образования – ядра, гранулы, мицеллы – частицы новой фазы образующейся ультрамикрогетерогенной системы, отделенные от среды высокоразвитой поверхностью раздела. Условия для возникновения зародышей новой фазы возникают лишь в нестабильной системе (пересыщенных растворах, пересыщенном паре) в местах, где образуются местные пресыщения – флуктуации концентрации или плотности.
Размеры образующихся частиц зависят от условий проведения конденсации, от соотношения между скоростями двух одновременно идущих процессов: образования зародышей и их роста. Для получения мелких частиц, т.е. частиц дисперсной фазы будущего коллоидного раствора, необходимо, чтобы скорость первого процесса превышала скорость второго. Практически такие условия создаются в весьма разбавленных растворах, в которых скорость роста частиц весьма невелика и частицы под действием броуновского движения практически не оседают, находясь во взвешенном состоянии.
Различают физическую и химическую конденсацию. Одним из примеров физической конденсации является метод замены растворителя: раствор какого-либо вещества постепенно при перемешивании прибавляют к жидкости, в которой это вещество нерастворимо. Таким способом, например, можно получить гидрозоли серы, фосфора, канифоли, вливая их спиртовые растворы в воду.
Химическая конденсация основана на проведении химических реакций (окислительно-восстановительных, обмена, гидролиза), в результате которых образуются малорастворимые соединения. Чтобы получить их в виде коллоидного раствора нужно:
1) вести реакцию в разбавленных растворах для обеспечения необходимой дисперсности частиц и их седиментационной устойчивости;
2) одно из реагирующих веществ необходимо взять в избытке – для создания на поверхности частиц двойного электрического слоя и обеспечения агрегативной устойчивости.
Основным свойством лиофобных дисперсных систем является их термодинамическая неустойчивость, неравновесность, связанная с большим запасом избыточной свободной энергии на высокоразвитой поверхности раздела фаз. Поэтому в таких системах самопроизвольно протекает процесс слипания дисперсной фазы – коагуляция.
Для придания лиофобным золям агрегативной устойчивости (устойчивость против коагуляции) необходимо создать на поверхности частиц защитные слои.
1) образующийся на поверхности твердой частицы двойной электрический слой: при избирательной адсорбции ионов определенного знака, появляются силы электростатического отталкивания одноименно заряженных частиц дисперсной фазы;
2) образование на поверхности частицы сольватных слоев, которые в силу своих особых структурно-механических свойств препятствуют соприкосновению и слипанию частиц.
Таким образом, стабилизаторами лиофобных золей тонких суспензий могут служить ионы в растворе а также поверхностно-активные вещества, создающий на поверхности раздела фаз сольватно-адсорбционные слои.
Способов образования ДЭС или сольватного слоя несколько.
1. Достройка кристаллической решетки. В этом случае на поверхности твердой фазы сорбируются ионы, теоретически способные принять участие в строительстве кристаллической решетки. Таким образом, ионы должны быть идентичны ионам, входящим в состав твердой фазы либо являться изоморфными (подходящий радиус иона и похожие химические свойства):
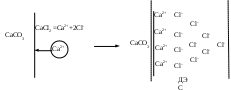
2. Принцип образования малорастворимого соединения.
В этом случае на поверхности кристалла сорбируются ионы, которые теоретически могут создать малорастворимое соединение с элементами, входящими в состав осадка:
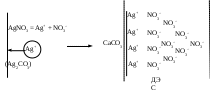
3. Принцип поверхностной диссоциации. С поверхности в раствор диссоциируют те или иные ионы. Тип иона определяется величиной изоэлектрической точки (ИЭТ), т.е. концентрации потенциалопределяющих ионов, при которой суммарный заряд (поверхности) равен нулю.
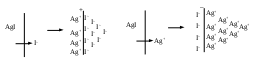
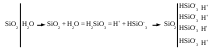
ИЭТ+ = −lgC+; ИЭТ− = −lgС−.
Для малорастворимых соединений ИЭТ определяется величиной произведения растворимости L.
Малорастворимое соединение диссоциирует по схеме:
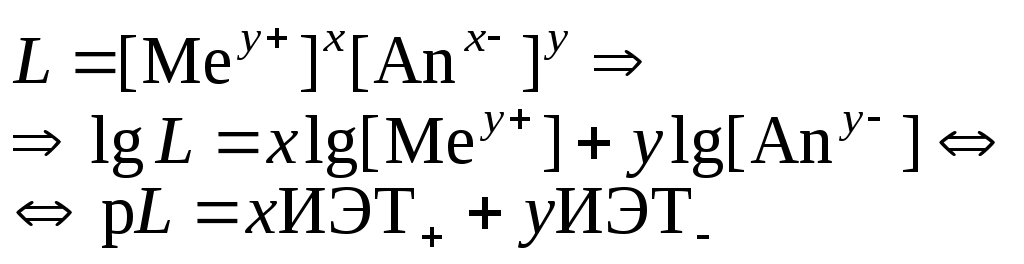 .
.Положительный заряд поверхности получается при р[Me] > ИЭТ+; p[An] < ИЭТ−.
Отрицательный заряд поверхности получается при р[Me] < ИЭТ+; p[An] > ИЭТ−.
Для слабых не растворимых кислот и оснований ИЭТ = рН«0». Например, для слабой двухосновной кислоты H2An pHИЭТ = 0,5(рK1 + pK2).
4. Сорбция твердой поверхностью ионов с высоким сорбционным потенциалом, например, ионов H+, OH− и др.
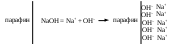
5. Ориентирование полярных молекул.
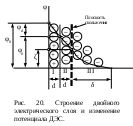
Двойной электрический слой имеет довольно сложную структуру (рис. 20). Первый слой состоит из потенциалопределяющих ионов – тех ионов, которые создают заряд поверхности φ0. Потенциалопределяющие ионы удерживаются на поверхности за счет сил хемосорбции. К потенциалопределяющим ионам за счет сил электростатического взаимодействия из раствора притягиваются противоионы, которые создают слой II и слой III.
Слой II называется плотным слоем (слоем Штерна, слоем Гельмгольца). Ионы плотного слоя примыкают к заряженной поверхности. Внутри плотного слоя противоионы распределены равномерно. Плотный слой обычно имеет толщину порядка диаметра гидратированного иона d. Ионы плотного слоя примыкают к заряженной поверхности и связаны с нею двумя видами сил: адсорбционными и электростатическими. При движении коллоидной частицы в дисперсионной среде плотный слой остается связанным с дисперсной частицей. Эту часть ДЭС можно рассматривать, как плоский конденсатор, потенциал которого с увеличением расстояния от поверхности снижается линейно.
Слой III называется диффузным (или слоем Гуи). Диффузный слой имеет некоторую толщину δ. Толщина плотного слоя d мала (< 1 нм) и постоянна. Толщина диффузного слоя δ существенно больше (может больше 10 нм) и сильно зависит от концентрации электролитов. При высоких концентрациях электролитов или при введении многозарядных ионов δ мала и стремится к нулю. В пределе δ = 0 и частица не заряжена. В этом случае, противоионы адсорбционного слоя полностью компенсируют поверхностный заряд ядра. В результате достигается так называемое изоэлектрическое состояние, часто сопровождающиеся потерей агрегативной устойчивости системы.
В
 слое Гуи ионы распределены не равномерно, связаны только за счет сил электростатического взаимодействия. По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При перемещении коллоидной частицы в дисперсионной среде ионы диффузного слоя могут отрываться. При отрыве ионов диффузного слоя возникает электрокинетический или ζ-потенциал. Гипотетическая поверхность отрыва ионов диффузного слоя называется плоскостью скольжения. ζ-потенциал является важнейшей характеристикой ДЭС. Он определяет скорость относительного перемещения дисперсной фазы и дисперсионной среды; интенсивность электрокинетических явлений (электроосмос, электрофорез); устойчивость золей.
слое Гуи ионы распределены не равномерно, связаны только за счет сил электростатического взаимодействия. По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При перемещении коллоидной частицы в дисперсионной среде ионы диффузного слоя могут отрываться. При отрыве ионов диффузного слоя возникает электрокинетический или ζ-потенциал. Гипотетическая поверхность отрыва ионов диффузного слоя называется плоскостью скольжения. ζ-потенциал является важнейшей характеристикой ДЭС. Он определяет скорость относительного перемещения дисперсной фазы и дисперсионной среды; интенсивность электрокинетических явлений (электроосмос, электрофорез); устойчивость золей. Под действием электрического поля могут двигаться дисперсная фаза относительно дисперсионной среды (электрофорез) или дисперсионная среда относительно дисперсной фазы (электроосмос). Механическое движение дисперсной фазы относительно дисперсионной среды (седиментация) вызывает возникновение электрической разности потенциалов (потенциал седиментации). Если электрическая разность потенциалов возникает при движении дисперсионной среды относительно дисперсной фазы, то такое явление называют потенциалом протекания.
Наибольшее распространение из электрокинетических явлений получили электроосмос и электрофорез. Значение электрокинетического потенциала, возникающего при электроосмосе или электрофорезе можно рассчитать по уравнению Гельмгольца-Смолуховского:
