Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 512
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
Одним из простейших частных случаев диаграмм состояния является изображение системы с полной растворимостью компонентов в обеих равновесных фазах. Следует отметить, что внешний вид и общие принципы чтения таких диаграмм состояния одинаковы как для конденсированных, так и для неконденсированных систем. В данном случае можно выделить три основных вида диаграмм состояния (рис. _____). При анализе таких диаграмм на них надо, прежде всего, выделить гомогенные области, т.е. зоны существования непрерывных фаз: твердых, жидких или газообразных растворов. Выше верхней линии (для равновесий «твердое тело – жидкость» она называется линией ликвидуса), выражающей зависимость состава высокотемпературной фазы от температуры равновесия, расположена более высокотемпературная фаза. Для равновесий «жидкость – пар» – это пар, а для равновесий «твердое тело – жидкость» – жидкость.
Ниже нижней линии (для равновесий «твердое тело – жидкость» она называется линией солидуса), выражающей зависимость состава низкотемпературной фазы от температуры равновесия, расположена более низкотемпературная фаза. Для равновесий «жидкость – пар» – это жидкость, а для равновесий «твердое тело – жидкость» – твердое тело.
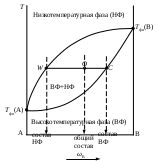
Рис. ____. Изобарическая диаграмма состояния двухкомпонентной системы с неограниченной растворимостью веществ.
На рис. _______ показаны экстремальные точки М, в которых смеси кипят (или плавятся) как индивидуальное вещество, т.е. при кипении или плавлении состав системы остается постоянным. Для неконденсированных систем такой состав называется азеотропным. Азеотропную смесь невозможно разделить на индивидуальные компоненты методом простой перегонки. Смеси, составы которых находятся слева от точки М, могут быть в принципе разделены на компонент А и азеотропную смесь. Если состав исходной смеси находится левее точки М, то такую смесь можно разделить на компонент В и азеотропную смесь. Сказанное справедливо и для конденсированных систем. Полностью компоненты А и В методом дробной кристаллизации разделить также не возможно.
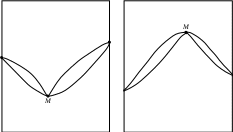
Рис. ____. Изобарическая диаграмма состояния двухкомпонентной системы с неограниченной растворимостью веществ с экстремальными точками
При перегонке бинарной смеси парциальные давления компонентов рА и рВ обоих компонентов в паровой фазе определяются законом Рауля (в приближении, что пары подчиняются законам идеальных газов)
где
Поскольку в бинарной системе хВ = 1 – хА, отношение парциальных давлений в паровой фазе определяется уравнением
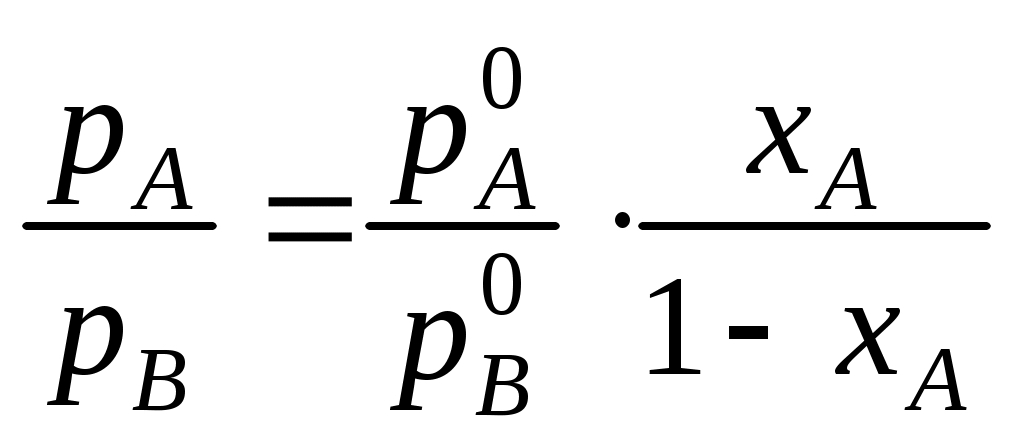 .
.Парциальное давление компонента в газовой фазе pi кроме того связано с общим давлением пара РΣ через мольные доли обоих компонентов в паровой фазе уi:
Тогда
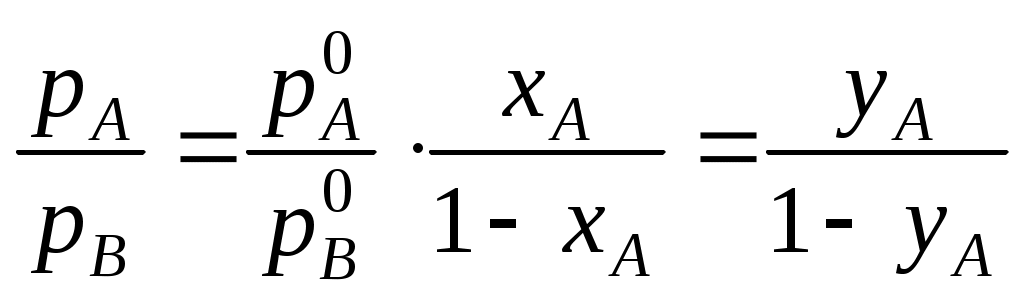 .
.Если компонент А более летуч, чем компонент В, то индекс при обозначении мольной доли его в жидкой и газовой фазе можно опустить:
где
Последнее уравнение представляет зависимость между относительными концентрациями легкокипящего компонента в парах и в жидкости. Пар и жидкость различны по составу только тогда, когда α > 1. И лишь в этом случае возможно разделение компонентов при перегонке. Обогащение паров легко летучим компонентом чем больше, чем больше α, т.е. чем больше различаются давления насыщенных паров чистых компонентов.
Если разделяемые соединения отличаются по своей летучести незначительно, то их невозможно удовлетворительно разделить методом простой перегонки. В таких случаях процесс испарения и конденсации следует повторять многократно, т.е. применять методы ректификации или фракционированной перегонки. При выборе метода разделения можно руководствоваться следующим эмпирическим правилом: ректификационная
перегонка должна применяться в тех случаях, когда температура кипения разделяемых соединений отличаются менее чем на 80°С.
Контрольные вопросы
1. Какими независимыми переменными определяются свойства двухкомпонентных систем?
2. Какие системы называют неконденсированными?
3. Какое основное уравнение описывает гетерогенные фазовые равновесия?
4. Какие показатели двухкомпонентной системы можно определить на основании изучения диаграмм состояния?
5. Что показывают линии ликвидуса и солидуса?
6. Возможно ли разделение компонентов азеотропной смеси методом простой перегонки?
7. Как при помощи диаграммы состояния определить состав равновесных фаз?
8. Для чего применяется правило рычага при расшифровке диаграмм состояния?
9. Какие особенные свойства имеет точка эвтектики?
10. Какие самые распространенные способы построения диаграмм состояния?
11. В чем суть аналитического метода?
12. Каковы основные принципы метода построения диаграммы состояния конденсированной системы на основании изучения кривых охлаждения?
13. Каким законом определяются парциальные давления компонентов при перегонке бинарной смеси?
14. Каким уравнением связано парциальное давление компонента в паровой фазе с общим давлением пара?
15. Каким уравнением определяется отношение парциальных давлений компонентов в паровой фазе?
16. Каким компонентом обогащена паровая фаза при перегонке?
Лабораторная работа №6. Получение кривой разгонки
Цель работы: изучить особенности перегонки двухкомпонентной системы; составить материальный баланс процесса перегонки.
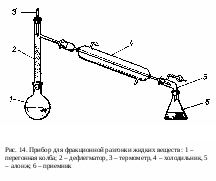
Сущность метода: Дробная (или фракционная) перегонка применяется для выделения в чистом виде компонентов смеси жидкостей, отличающихся по температурам кипения и не образующих друг с другом азеотропных смесей. В зависимости от природы компонентов прибор нагревают на водяных банях, электроплитках или горелкой на асбестовой сетке.
Смесь разгоняют в приборе (рис. 14). После того как прибор собран и установлен, вынимают пробку с термометром из дефлегматора. Вставляют воронку (конец ее трубки должен находиться ниже отвода у дефлегматора) и наливают смесь. На дно колбы помещают «кипелки». Дистиллят должен поступать в приемник со скоростью 30-40 капель в минуту.
В ходе разгонки собирают три фракции: первая фракция – от начала перегонки до момента, когда температура кипения начнет быстро повышаться. Быстрое повышение температуры означает ее подъем на 5 – 7°С в течение 10 – 20 с. Собранную фракцию после измерения ее объема переливают в плоскодонную колбочку. Вторая фракция (промежуточная) собирается во время быстрого повышения температуры отходящих паров. Третья фракция (окончательная) собирается с момента прекращения быстрого роста температуры до конца перегонки.
Перегонку прекращают, когда в перегонной колбе остается 2-3 мл жидкости. Для лучшего разделения смеси веществ проводят вторичную разгонку. В перегонную колбу помещают первую (головную) фракцию и перегоняют ее в прежних температурных пределах. При этом получающаяся фракция обогащается низкокипящим компонентом.
Когда температура отходящих паров достигнет верхней границы первого температурного интервала, перегонку прекращают. Прибор охлаждают. В перегонную колбу добавляют среднюю фракцию от первой перегонки и вновь начинают разгонку, как описано выше. По окончании перегонки средней фракции к остатку приливают третью фракцию и продолжают разгонку
, собирая фракции во второй и третий приемники. При многократном повторении разгонки средняя фракция значительно уменьшается, разделяясь на первую и третью фракции. При этом происходит сужение температурных интервалов крайних фракций. Таким способом удается достаточно хорошо разделить смесь компонентов. При прерывании перегонки необходимо каждый раз добавлять новые «кипелки».
Для работы используются системы, в которых оба компонента значительно отличаются по температуре кипения (при наличии азеотропных смесей это не столь существенно) и по показателю преломления. Например: бензол – ацетон; бензол – хлороформ; дихлорэтан – толуол; четыреххлористый углерод – ацетон; ацетон – хлороформ; пропиловый спирт – четыреххлористый углерод; этиловый спирт – вода; четыреххлористый углерод – этиловый спирт; этиловый спирт – бензол. Ниже приведены характеристики перечисленных веществ.
| Вещество | Химическая формула | Ткипения, °С | Показатель преломления | Плотность, d20 г/см3 |
| Бензол | С6Н6 | 80 | 1,5011 | 0,8790 |
| Ацетон | СН3СОСН3 | 56 | 1,3588 | 0,7905 |
| Хлороформ | СНСl3 | 61 | 1,4449 | 1,489 |
| 1,2-Дихлорэтан | CH2ClCH2Cl | 83 | 1,4448 | 1,2570 |
| Толуол | C6H5CH3 | 111 | 1,4969 | 0,8670 |
| Четыреххлористый углерод | CCl4 | 77 | 1,4603 | 1,5940 |
| Пропиловый спирт | CH3CH2CH2OH | 97 | 1,3853 | 0,8040 |
| Этиловый спирт | CH3CH2OH | 78 | 1,3611 | 0,7893 |
| Вода | H2O | 100 | 1,3330 | 0,9982 |
| | | | | |
