ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 164
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
Метод основан на определении удельной электропроводности дистиллированной (ГОСТ 6709) и бидистиллированной воды (ГОСТ Р 52501). Значение удельной электропроводности дистиллированной воды не должно превышать 0,5 мСм/см. В зависимости от способа очистки дистиллированной воды различают две степени очистки.
Степень 1. Вода, в основном свободная от растворимых или коллоидных ионных и органических примесей и отвечающая жестким аналитическим требованиям, например, таким, как для метода высокоэффективной жидкостной хроматографии; такую воду получают путем дальнейшей очистки воды 2-й степени чистоты (например, обратным осмосом или деионизацией с последующим фильтрованием через мембранный фильтр с размером ячейки 0,2 мкм для удаления частиц или двойной перегонкой с применением аппаратуры из кварцевого стекла). Удельная электрическая проводимость при температуре 25°С такой воды не должна превышать 0,01 мСм/м.
Степень 2. Вода с очень низким содержанием неорганических, органических или коллоидных примесей, используемая для чувствительных аналитических методов, включая метод атомно-абсорбционной спектрометрии (ААС) и определение компонентов в следовых количествах; такую воду получают, например, неоднократной перегонкой либо деионизацией или обратным осмосом с последующей перегонкой. Удельная электрическая проводимость при температуре 25°С такой воды не должна превышать 0, 1 мСм/м.
Ход определения
-
Определение качества очистки дисстилированной воды.
Удельную электрическую проводимость пробы анализируемой воды измеряют, используя кондуктометр с термостатируемой ячейкой, установив температуру воды (20±1)°С.
-
Опредление качества очистки бидистиллированной воды
Для проведения анализа бидистиллированной воды очень важно, чтобы атмосфера была чистой и в ней не было пыли, а также необходимо принять соответствующие меры предосторожности, чтобы предотвратить какое-либо загрязнение пробы и пробы для анализа.
Удельную электрическую проводимость пробы анализируемой свежеприготовленной воды измеряют, используя кондуктометр с термостатируемой ячейкой, установив температуру воды (25±1)°С.
-
Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
-
Определение слабой кислоты и соли слабого основания в их смеси.
При титровании сильным основанием смесей кислот с солями слабых оснований в растворе реализуются следующие равновесия:
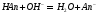
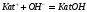
Из расчета теоретических
кривых титрования следует, что при
значениях
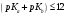 — сначала реагирует кислота, а затем
вытесняется слабое основание из его
соли; при
— сначала реагирует кислота, а затем
вытесняется слабое основание из его
соли; при
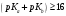 — реакция вытеснения слабого основания
из соли предшествует реакции взаимодействия
кислоты с титрантом; при значениях
— реакция вытеснения слабого основания
из соли предшествует реакции взаимодействия
кислоты с титрантом; при значениях
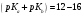 — обе реакции протекают параллельно,
дифференцированное титрование невозможно.
— обе реакции протекают параллельно,
дифференцированное титрование невозможно.
Для борной кислоты
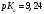 ;
для гидрохлорида гидроксиламина
;
для гидрохлорида гидроксиламина
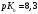 ;
следовательно
;
следовательно
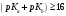 ,
то есть сначала титруется соль
гидроксиламина, а затем кислота.
,
то есть сначала титруется соль
гидроксиламина, а затем кислота.
Ход работы.
-
Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
1. Бюретку заполняют раствором
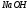 .
.
2. Аликвотную часть 5,0 см3 раствора HCl переносят в измерительную ячейку с помощью пипетки. В раствор помещают кондуктометрический датчик.
3. Включают магнитную мешалку, измеряют значение удельной электропроводности æ исходного раствора и записывают в таблицу 12.1.
4. Приливают по 0,5 см3 титранта до объема титранта 10,0 см3. Измерение удельной электропроводности æ проводят через 20 сек после прибавления очередной порции титранта и записывают в таблицу 12.1.
7. Титрование повторяют 3 раза.
8. По результатам титрования строят
кривые титрования в координатах
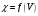 .
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
.
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
9. Находят средний объем раствора, израсходованного на титрование.
10. По известным формулам рассчитывают
С(1/1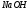 )
и Т(
)
и Т(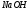 ).
).
-
Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
1. Анализируемый раствор переносят в мерную колбу вместимостью 100,0 см3 и доводят до метки дистиллированной водой.
2. В ячейку для титрования отбирают аликвотную часть анализируемого раствора (10,0 см3).
3. Приливают по 0,5 см3 титранта до объема титранта 15,0 см3, обнаруживая два скачка потенциала.
4. По результатам точного титрования
в водном растворе строят кривые титрования
в координатах
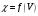 .
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
.
Апроксимируют полученные зависимости
уравнениями линейной регрессии и
математически находят точку пересечения
– объем титранта в точки эквивалентности.
5. Рассчитывают содержание и концентрацию борной кислоты и солянокислого гидроксиламина по известным формулам.
-
Определение ионов и в их смеси методом кондуктометрического титрования
Определение ионов
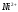 и
и
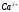 основано на реакции комплексообразования
ионов металлов с двунатриевой солью
этилендиаминтетрауксусной кислоты
(ЭДТА, сокращенная запись
основано на реакции комплексообразования
ионов металлов с двунатриевой солью
этилендиаминтетрауксусной кислоты
(ЭДТА, сокращенная запись
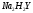 ).
В зависимости от
).
В зависимости от
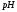 среды при титровании могут образовываться
средние и протонированные комплексонаты,
а также различные продукты диссоциации
этилендиаминтетрауксусной кислоты.
среды при титровании могут образовываться
средние и протонированные комплексонаты,
а также различные продукты диссоциации
этилендиаминтетрауксусной кислоты.
При титровании ЭДТА солей
металлов в растворах, не содержащих
буферных смесей, на кривой титрования
имеется максимум, соответствующий точке
эквивалентности. До точки эквивалентности
электропроводность раствора растет за
счет увеличения концентрации наиболее
подвижных ионов
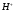 в соответствии с реакцией, происходящей,
например, при
в соответствии с реакцией, происходящей,
например, при
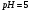 :
:
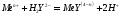
После точки эквивалентности
электропроводность раствора уменьшается
в результате связывания
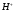 избытком титранта в малодиссоциированную
кислоту:
избытком титранта в малодиссоциированную
кислоту:
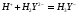
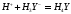
Если при титровании образуется
средний комплексонат высокой устойчивости,
характеризующийся
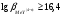 (например,
(например,
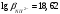 ),
то титрование можно проводить в отсутствии
буферного раствора. Титрование иона
),
то титрование можно проводить в отсутствии
буферного раствора. Титрование иона
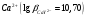 проводят в присутствии аммиачного
буферного раствора. При этом не происходит
разрушения ранее образовавшегося
комплексоната никеля, так как
проводят в присутствии аммиачного
буферного раствора. При этом не происходит
разрушения ранее образовавшегося
комплексоната никеля, так как
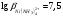 .
.
Ход работы.
1. Анализируемый раствор переносят в мерную колбу вместимостью 100,0 см3 и доводят до метки дистиллированной водой.
2. В ячейку для титрования (химический стакан) отбирают аликвотную часть анализируемого раствора (10,0 см3) титруют раствором ЭДТА. После того, как было зафиксирована первая точка, где наблюдалось снижение удельной электропроводности, снимают еще 4 точки, а затем вводят 10 см3 аммиачного буферного раствора (рН=10) и фиксируют вторую точку эквивалентности.
3. Проводят ориентировочное и точное титрование раствором ЭДТА до 15,0 см3 титранта, обнаруживая два скачка потенциала (первый до введения буферного растовра, второй – после введения буферного раствора). Результаты записываю в таблицы 12.3.
4. По результатам титрования в водном
растворе строят кривые титрования в
координатах
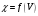 .
.
5. Рассчитывают содержание и концентрацию
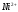 и
и
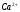 по известным формулам.
по известным формулам.
-
Определение сульфат-ионов методом кондуктометрического титрования
Метод определения сульфат – ионов основан на….
Ход определения
1. Бюретку заполняют раствором BaCl2.
2. Аликвотную часть 5,0 см3 раствора Na2SO4 переносят в измерительную ячейку с помощью пипетки. В раствор помещают кондуктометрический датчик.
3. Включают магнитную мешалку, измеряют значение удельной электропроводности æ исходного раствора и записывают в таблицу 12.1.
4. Приливают по 0,5 см3 титранта до объема титранта 15,0 см3. Измерение удельной электропроводности æ проводят через 20 сек после прибавления очередной порции титранта и записывают в таблицу 12.1.

